서 론
가축에 첨가하는 다양한 보조사료는 국가가 제정한 법령에 의해 규제를 받게 된다. 이는 사료를 섭취하는 가축의 안전 및 이를 제조하거나 취급하는 근로자 및 동물성 식품을 섭취하는 인간과 환경에 안전성을 보증해야 하기 때문이다. 사료관리법은 사료의 품질관리와 안전성 확보 등에 필요한 동물의 범위 및 사료의 범위와 명칭, 유해물질의 함량, 표준 분석 방법 등을 포함하고 있다. 2023년 10월 농림축산식품부에서는 사료의 기준 및 규격에 단미사료와 보조사료 외에 메탄저감제의 기준을 새롭게 설정하였다. 메탄저감제란 단미사료 및 보조사료로 기준 및 규격이 설정된 물질 중 가축 장내발효로 발생되는 메탄을 10% 이상 감축할 수 있는 제품으로 한정하고 있다. 또한 저메탄사료는 메탄 저감제를 가축의 성장단계에 따라 급여량에 맞게 첨가한 사료를 말한다[1]. 국내에서 사용 가능한 메탄저감제는 정량분석을 통하여 품질 관리가 가능하면서, 가축의 건강 및 생산성에 유의적인 저하 및 안전성에 영향을 미치지 않는 사료이어야 한다. 이와 같이 탄소 중립의 일환으로 축산 분야 저메탄사료의 보급을 위한 정책이 활성화 되면서, 온실가스 배출량을 감축시킬 수 있는 환경 친화적인 사료 개발 및 생산이 활발히 진행되고 있다.
메탄(CH4)은 식물성 사료를 소화하는 한우, 젖소, 염소와 같은 반추가축의 주요 장기인 반추위의 미생물에 의해 생성된다. 반추가축 사료의 주요 구성성분인 섬유질은 반추위내 미생물에 의해 분해되어 휘발성지방산과 메탄을 생성한다. 대부분의 메탄은 반추위내 고세균인 메탄생성균에 의해 발효과정에서 생성된 수소 가스의 일부를 이용하여 발생된다. 이렇게 반추가축에서 생성된 메탄은 기후변화에 관한 정부 간 협의체(Intergovernmental Panel on Climate Change, IPCC) 제 6차 평가보고서(Sixth Assessment Report, AR6)에 따르면 100년 기준으로 이산화탄소(CO2)보다 약 25배 정도 더 강력한 지구 온난화 효과를 가지고 있는 것으로 보고되고 있다[2].
메탄은 대기 중에 오래 머무르지 않고 빠르게 분해되지만, 분해되기 전에 기체와 액체 상태로 존재하며 온실 효과를 발생시킨다. 또한 오존층을 파괴하는 전구체로서 질소 산화물과 같은 물질과 반응하여 광화학 스모그를 형성하여 산성비, 식물 피해 등 환경 문제를 야기시킬 수 있다. 이외에도 다양한 농업 생산성에 영향을 미치며, 이는 사회 및 경제적 비용 상승을 가져올 수 있다. 따라서 메탄 배출량 감축은 미래 환경을 보존하는 필수적인 조건으로, 이러한 문제를 해결하기 위해 다양한 조치가 필요하다고 할 수 있다. 따라서 본 연구에서는 저탄소 축산업을 위한 방안으로 반추가축에서 발생하는 메탄 배출량 및 감축 방안을 모색하고, 감축 기술을 농가 현장에 적용할 수 있는 방안을 검토하는 데 있다. 특히 현재까지 이용 가능한 메탄저감제의 특성 및 저감 효과에 대한 수용 가능성을 구체화 하고자 하며, 이를 통해 지속 가능한 반추가축 생산 방안을 채택하여 환경 보호와 경제적인 이익을 동시에 추구하고자 한다.
국내 반추 가축 메탄 배출 현황
환경부에서는 축산 부문에서 발생하는 메탄 배출량을 산정하여 매년 국가 온실가스 인벤토리 보고서를 발간하는데, 축산 부문에서 발생하는 주요 온실가스인 메탄은 반추가축의 소화기관내 발효에 의해 발생하는 장내 발효와, 가축 분뇨의 혐기적 분해 과정에서 발생된다고 한다. 이때 온실가스의 영향력을 결정하는 지구 온난화지수(global warming potential)는 온실가스별 배출량을 비교 및 관리하는데 중요한 지표로서, 메탄의 경우 지구 온난화에 미치는 영향을 이산화탄소와 비교하여 수치화 시킨다. IPCC 제 6차 평가보고서에 따르면, 메탄의 지구 온난화지수는 100년을 기준으로 이산화탄소보다 28배, 20년을 기준으로 84배 더 높은 온난화 효과를 가지는 것으로 계산되었다. 또한 2023년 국가 온실가스 인벤토리 보고서에 적용되는 장내발효에 의한 메탄 배출량은 2022년까지 산정하였던 1996년 IPCC 기본배출계수를 적용하지 않고, 2006년 IPCC 기본배출계수를 적용하였으며 국가 고유 배출계수가 있을 경우에는 국가 고유 배출계수를 적용하는 것으로 변경되었다(Table 1).
IPCC, Intergovernmental Panel on Climate Change.
2021년 농업분야 온실가스 배출량은 국가 총 배출량의 3.2%인 21.4백만 톤(CO2eq)으로 전년대비 1.1% 증가하였으며, 축산 부문은 10.8백만 톤으로 전체 농업 분야의 45%를 차지하고 있다. 이때 장내 발효에 의한 배출량은 4.9백만 톤으로 20년 대비 3.5% 증가하였으며, 가축분뇨 처리부문에서도 5.4백만 톤으로 4.2% 증가하였다[3]. 메탄 배출량 증가는 국내 한·육우 사육 두수의 증가가 주요 요인으로 2024년 2월 한·육우의 사육 두수는 3,872,877두로 전년 3,975,966두에 비해 2.3% 감소하였으나, 지속적인 사육두수의 증가에 기인하고 있다. 한·육우의 장내 발효에 의한 메탄 배출량은 전체 축종별 배출량의 67.7%로 가장 많으며, 다음으로 젖소(21.3%), 돼지(7.4%), 양과 염소 순으로 배출되었다.
2018년 대비 2030년 온실가스 배출량 40% 감축을 목표로한 국가 온실가스 감축 목표 상향안이 2023년 8월 확정되었으며, 농·축산 부문의 감축량은 2018년 목표대비 11.9% 감축한 27.1% 감축을 목표로 설정하였다. 축산 부문 온실가스 감축을 위해 정부에서는 장내발효 부문에서 2030년까지 저메탄사료 30% 보급, 저단백사료 및 생산성 향상을 통해 447.1만 톤 CO2eq에서 370.2만 톤으로 76.9만 톤 감축과 가축분뇨 처리 개선을 통해 90만 톤 CO2eq 감축을 계획하고 있다.
반추가축의 메탄 생성 과정
반추위에는 사료를 분해하는 다양한 미생물들이 서식하고 있으며, 이 미생물 중 일부는 고세균(고균)으로 존재하며 수소를 전자 공여체로 사용하는 균과 암모니아산화 및 황을 전자 수용체로 사용하는 균류가 많이 존재한다. 고세균은 크게 다섯 개의 고세균 문(phyla)로 분류할 수 있으며, 주요 미생물문으로는 Euryachaeota, Crenarchaeota, Thaumarchaeota, Koraarchaeota및 Nanoarchaeota로서 많은 양의 메탄을 생성하는 균들은 Euryachaeota에 포함된다. 대부분의 메탄 생성균(methanogens)은 산소가 있는 곳에서는 생존하기 어려운 절대 혐기성 균들로, 혐기적 환경 조건에서 이산화탄소를 최종 전자 수용체로 사용하며 수소를 전자공여체로 하여 메탄으로 환원된다. 반추위내 사료가 메탄으로 전환하기 위해서는 전구 물질인 수소 및 이산화탄소를 공급할 수 있으면서, 영양 대사를 같이 진행할 수 있는 공생미생물들이 있어야 한다. 반추위내 섬유소를 분해하는 다양한 공생미생물은 가수분해과정을 통해 최종 산물인 휘발성지방산, 젖산, 알코올, 메탄올, 수소 및 이산화탄소 등으로 전환이 된다. 반추위내 메탄생성은 이산화탄소 환원 경로와 메탄올이나 메틸아민계통의 메틸영양물질을 이용하는 경로, 아세트산을 이용하여 생성하는 경로로 구분된다. 일반적으로 이산화탄소가 메탄으로 환원되는데 필요한 전자로 많은 고세균들이 수소를 이용하며, 반추위내 미생물의 발효과정에서 생성된 이산화탄소는 메탄생성균에 의해 7단계의 메탄생성과정을 통해 메탄으로 환원된다. 이 과정 가운데 여러 특정 효소들이 작용하여 이산화탄소가 메틸기로 환원이 되고 환원된 메틸기는 메틸전이효소에 의해 CoM을 함유한 메틸-CoM으로 전환되며 다시 메틸 환원효소에 의해 메탄으로 환원이 된다.
반추가축에 의한 메탄은 출생후 4주부터 반추위에서 발생되며, 반추위가 성장하면서 급격하게 증가한다[4]. 메탄생성에 의한 총에너지의 손실은 2%–12%로 사료의 소화율에 따라 변동성을 지니며, 탄수화물 발효 속도와 통과율에 의해 영향을 받기도 한다. 또한 휘발성지방산에 초산과 프로피온산의 생성 비율(0.9–4.0)에 따라 메탄 발생량은 차이를 보인다. 2018년 Institut National de la Recherche Agronomique(INRA)의 분석결과에 따르면 총에너지의 손실은 분에서 33.3%, 메탄 6.3% 뇨 3.9%로 결과적으로 56.4%의 대사에너지가 생성되는 것으로 보고되고 있다. 그러나 장내 메탄생성을 억제하는 것으로 가축의 에너지 대사가 향상되거나, 사료의 효율을 높일 수 있을 것으로 예측하기는 어렵다[5,6].
반추위에는 다양한 미생물 군이 존재하며, 주요 미생물 군집으로는 혐기성 박테리아, 혐기성 곰팡이, 프로토조아 및 고세균이 서식하고 있다. 프로토조아는 전체 반추위 바이오매스의 절반을 차지하고 있으며 곰팡이는 약 8%, 나머지 부분은 박테리아가 차지하는 것으로 추정하고 있다[7]. 이중 주요 박테리아문은 Firmicutes, Bacteroidetes 및 Proteobacteria가 가장 풍부하며, 수소를 만들어내는 박테리아는 Ruminocccus 및 Firmicutes를 포함하는 Eubacterium spp. 등이 존재한다. 미생물 군집 분석을 통해 메탄 생성량이 낮은 동물은 프로피온산을 생산하는 Quinella ovalis, 수소를 생산하지 않는 Fibrobacter spp., Kandleria vitulina 및 Prevotella bryantii의 상대적 풍부도가 높으며, 메탄 발생량이 많은 형은 Ruminococcus, Ruminococcaceae, Lachnospiraceae 및 Clostridiales 등의 상대적 풍부도가 높게 보고되었다[8]. 앞서 설명한 대로 반추위 메탄 생성균은 반추위내 존재하는 다양한 미생물에 의해 사료의 발효과정에서 나온 수소 및 이산화탄소를 이용하여 메탄을 생성하며, 반추위내 박테리아, 프로토조아 및 곰팡이 등의 상호작용을 통해 고세균의 성장과 메탄생성량은 달라질 수 있다. 미생물에서 발견되는 16S 리보좀 RNA 분석은 최근 미생물의 군집 분석에 많이 이용되며, 이러한 분석에 의하면 반추위의 고세균은 전체 미생물 군집의 3.3%를 차지하고 있다. 또한 배양된 메탄생성균은 고세균의 0.7%만을 차지하고 있는 것으로 보고되었다[9]. 수소를 이용하는 주요 메탄생성균으로는 Methanobrevibacter 속에 속하며 이는 두 개의 그룹으로 나뉘어 SGMT 계통군인 Mbb. smithii, Mbb gottschalkii, Mbb millerae 및 Mbb thaueri 계통과 RO 계통군으로 Mbb ruminantium 및 Mbb olleyae이 있으며, 또 다른 수소 이용 메탄균으로는 Methanosphaera, Methanimicrococcus 및 Methanobacterium이 있다. 이 중 SGMT 계통군(clade)은 메탄 생성량과 양의 상관관계가 있는 것으로 보고되고 있다[10,11]. 반추위에 존재하는 메탄생성균은 품종에 따라 우점종이 각기 다르게 나타나는데, 섬유질 배합사료를 먹인 젖소의 반추위에는 Methanobrevibacter ruminantium이 우점하며 그 다음으로는 Methanosphaera stadtmanae가 우점하는 것으로 밝혀졌다. 또한 메탄생성균과 사료의 품질간의 연계성을 보면 고에너지 사료를 급여한 축우에서 Methanobrevibacter smithii가 우점하고 있으며, 에너지 함량이 낮은 사료에서 주로 Methanobrevibacter ruminantium이 우점하는 것으로 알려져 있다[12].
탄수화물의 조성은 반추위 pH에 영향을 미치며 결과적으로 반추위내 미생물군과 메탄 발생량에 변화를 줄 수 있다. 또한 섬유질 함량이 많은 조사료의 함량이 높을 수록 전체 메탄 발생량은 증가하게 되며, 쉽게 분해되는 전분 성분이 많은 사료와 가용성 탄수화물의 함량이 높을 수록 pH 감소와 프로프온산 형성을 촉진하여 메탄 생성량은 감소한다. 지방은 메탄 생성량에 미비한 영향을 미치나 지방 1%당 메탄 저감율은 소에서 3.77%의 감소효과가 있으며, 지방산중 C12:0, C18:3 및 다중 불포화지방산은 대체적으로 포화지방산보다 메탄 감소효과가 우수한 것으로 보고되었다[13]. 지방산의 메탄 저감 효과를 높이기 위해 단일 지방산보다는 혼합한 지방 화합물이 더욱 효과적인 것으로 알려져 있으며, 라우릭산, 아마인유 및 칼슘 퓨마릭산을 혼합하여 급여시 메탄 저감효과는 더욱 증가하였다. 사료내 지방의 함량을 높일 수록 반추위 메타노젠의 다양성과 대사 활동이 감소하며, 전체적인 미생물의 종 구성이 변화된다[14]. 사포닌, 탄닌, 플라보노이드 및 에센셜 오일과 같은 식물의 2차 대사산물은 반추위 미생물에 대하여 항균 활성을 가지고 있으며, 이에 일부 식물 2차대사산물은 반추위내 메탄균의 억제와 더불어 메탄의 배출을 완화시키는 데 도움을 주는 것으로 보고되었다. 특히 Methanobacteriales, Thermoplasmata 고세균 등은 축합형 탄닌을 급여 시 영향을 받는 것으로 알려져 있으며[15]. 정향, 유칼립투스 및 페퍼민드와 같은 에센셜 오일도 고세균과 프로토조아의 성장을 억제하며 간접적으로는 수소를 생산하는 박테리아의 억제를 통해 직간접적으로 메탄의 억제가 된다[16].
메탄 저감 연구 동향
사료가 반추위 발효 조절에 영향을 미치는 주요 요인은 사료섭취량, 사료의 소화율, 휘발성 지방산을 포함하는 최종 발효 산물 및 pH변화가 주요 핵심 요소라 할 수 있다. 한 예로 사료효율을 개선하여 국내 한우의 비육기간을 28개월 단축할 경우 2018년 사육 마릿수 및 출하월령대비 약 2만 톤의 온실가스를 감축할 수 있는 것으로 분석되었다. 또한 출하월령을 26개월로 단축시 약 3만 8천 톤의 온실가스 감축효과가 있는 것으로 나타났다[17]. 비육우의 사육기간 단축을 위해서는 사료 효율 개선 및 가축 개량 등 가축의 생산성을 향상하기 위한 다양한 방안들이 제시되어야 하며, 가축의 증체 및 사육기간 단축을 위한 방안으로 사료의 효율을 높이는 것은 매우 중요한다. 사료 효율을 높이는 것은 메탄 발생량을 조절할 수 있는 방안으로, 반추가축의 사료효율 및 메탄 배출에 대한 다양한 연구들이 진행되어 왔다. 최근에는 메탄 배출량, 반추위 미생물 군집 변화 및 사료 이용 효율과의 연계성을 함께 분석하는 다각적인 검토가 이루어지고 있다. 일반적으로 반추위 메탄 발생량은 건물섭취량, 소화 가능한 유기물 섭취량, 사료의 조성, 반추위 미생물, 휘발성 지방산, 동물의 유전적 특성 및 환경요인에 의해 영향을 받는다. 한 예로 사료 효율은 섭취한 사료를 영양소로 전환하는데 반추가축의 능력에 따라 달라지며, 소화율이 낮은 사료나 섬유질 함량이 높은 사료를 급여하였을 때 메탄 발생량은 증가한다. 그러나 반추위 미생물 군집의 차이가 최종 발효산물 및 메탄 배출과는 유의적인 관련이 없는 것으로 보고되고 있으며[18], 다만 휘발성 지방산의 비율은 반추위 미생물 군집에 의해 영향을 받을 가능성이 높다. 사료원에 따른 메탄 발생량을 비교한 메타분석에 따르면 건물섭취량과 메탄배출량은 R2 = 0.8으로 선형 관계를 나타내며, 전분의 함량이 높은 사료를 급여할 경우 반추위내 전분 분해 박테리아와 젖산염을 활용하는 균수가 증가하므로 메탄생성균과 수소의 이용 효율이 높아 메탄 발생량이 감소하는 상관관계(R2 = 0.76)를 나타냈다. 또한 사료내 neutral detergent fiber(NDF) 함량과 메탄의 배출량은 유의한 상관관계를 보이지 않으나[19], 전분 및 NDF 성분은 젖소의 주요 에너지 공급원으로 전분/NDF 비율이 증가함에 따라 메탄 발생량은 감소하는 선형적인 관계를 나타냈다(R = 0.76). 전분 및 NDF의 비율이 증가함에 따라 젖소가 유생산에 필요한 에너지 공급을 증가시키면 우유 생산량도 증가된다. 그러나 전분/NDF의 비율이 0.72를 초과하게 되면 과도한 젖산 생산으로 반추위 pH가 감소하고, 섬유질을 분해하는 박테리아의 수가 감소하여 우유 생산량에도 영향을 받는다.
젖소에서는 사료 급여 방법에 따라 메탄발생량을 감소시킬 수 있는 것으로 알려져 있다. 오일, 두과작물, 옥수수 사일리지 및 농후 사료 함량을 증가시킬 경우 적게는 5%에서 20%까지 메탄 저감이 예상되는 것으로 나타났으며[20], 특히 농후 사료의 첨가 비율은 최소 35%–40% 이상 되어야 메탄 저감효과가 나타난다. 또한 사료의 가공방법에 따라 메탄 발생량이 영향을 받으며(Fig. 1), 조사료 및 단미사료를 분쇄하거나 펠렛화 할 경우 사료입자의 반추위 통과율이 증가하여 메탄 발생량이 감소하게 된다[21]. 또한 사일리지는 제조 과정에서 젖산 발효 과정을 통해 보전성을 높이는 효과뿐만 아니라, 발효 과정 중에 생성된 유기산(젖산, 아세트산, 프로피온산 및 부티르산)이 부분적인 가수분해를 촉진하고 섬유소와 리그린의 결합을 완화시킴으로 소화율 증가와 메탄 발생을 줄일 수 있다. 지방은 메탄 저감을 위한 중요한 물질로 중쇄지방산(C12, C14)은 반추위 프로피온산 발효를 촉진하고 프로토조아의 특정한 독성을 가지고 있으나, 지방이 메탄 저감효과를 가지려면 최소 2.89%–4.86% 이상 첨가할 때 그 효과가 있는 것으로 나타났다.

1979년부터 2018년까지 in vitro 배양 실험 조건에서 분석한 사료 첨가제의 메탄 저감효과를 나타낸 메타 분석결과에 의하면, 화학적 억제제, 전자 싱크, 에센셜 오일, 사포닌, 탄닌 및 식물추출물의 메탄저감효과는 각각 29.2%, 18.9%, 18.2%, 14.8%, 14.5% 및 14.5%로 감소하는 결과를 가져왔다. 그러나 미생물, 효소, 조류 및 유기산의 보충은 다양한 실험결과에서 유의적인 결과를 나타내지 않았다[22]. 일반적으로 반추위액을 이용하는 실험실에서 진행되는 in vitro 실험은 동물실험과 비교하여 적은 시간 내에 많은 수의 시료와 반복수를 확대할 수 있고, 메탄발생량을 측정하는데 강한 상관관계가 있으므로 첨가제의 메탄 저감효과를 예측할 수 있는 방안이 되고 있다[23]. 화학억제제로 제안되고 있는 3-니트로오기프로판올(3-nitrooxypropanol, 3-NOP)는 동물의 생산성에 부정적인 영향을 미치지 않으면서 최대 30%까지 메탄 저감효과가 있는 것으로 분석되었으며[24], 최근 메타 분석에 의하면 건물섭취량, 섬유소 소화율 및 체중증가에 영향을 미치지 않고 메탄 완화 효과가 있는것으로 보고되었다[25]. 메탄 저감효과가 있는 사료첨가제를 사용할 경우 일부 사료첨가제의 가축에 대한 독성을 고려하여야 한다. 그 예로 B-사이클로텍스트린의 경우 75% 이상의 메탄저감효과가 있는 것으로 보고되고 있으나, 소량의 첨가량에서도 독성이 있는 것으로 알려져 있으며[26], 질산염 첨가도 메탄 저감효과가 20% 정도이나 반추위내 암모니아의 증가 및 질산염 대사의 중간 생성물로 인한 잠재적 독성은 고려되어야 할 사항이다.
최근 메탄 저감효과가 우수한 해조류는 홍조류인 Rhodophyta문에 속하는 Asparagopsis armata및 Asparagopsis taxiformis가 대표적이다. 이 두 종은 반추가축 사료에 첨가할 경우 사료의 효율을 높이는 동시에 생물학적 활성을 지닌 할로겐 화합물을 포함하고 있으며, 최대 98%까지 메탄억제효과가 있는 것으로 나타났다[27,28]. 홍조류에는 항균, 효소 억제 및 항산화에 관여하는 다양한 생리활성 화합물이 포함되어 있는 것으로 알려져 있으며, 이중 바다고리풀로 불리는 Asparagopsis에는 브롬 화합물(tribromomethane, dibromochloromethane, dibromoacetic acid, bromochloroacetic acid, dibromotromethane 등)이 많이 포함되어 있다. 이중 A. armata의 bromoform 함량은 1.45%–1.67%로 금속 효소를 억제하여 메탄 생성을 억제하는 휘발성 물질이며, 특히 메틸 Co-M 환원효소에 경쟁적으로 결합하게 해주는 역할을 한다. 다만 메탄 저감제로 이용 가능성이 높은 홍조류는 주요 활성 물질의 독성 문제에 대한 접근이 이루어져야 하며, 홍조류에 포함되어 있는 메탄 저감물질인 bromoform은 상온에서 액체성분으로 존재하지만 흡입, 피부 흡수 및 섭취 시 중추신경계에 영향을 미친다[29]. 또한 일부 연구에서는 건물섭취량 1 kg당 바다고리풀을 1% 이상 고용량을 사용 할 경우에는 사료의 섭취량 및 우유 생산량이 감소하는 것으로 나타났다[30]. 따라서 홍조류 종인 바다고리풀을 사용시에는 주요 활성 물질의 독성 및 사료내 첨가량 등 안전성에 대한 문제를 고려해야 한다. 또한 할로겐 화합물이나 기타 천연 물질에 포함된 할로겐 물질은 오존 파괴, 우유나 고기와 같은 육류 제품 내의 잔류물, 동물 건강 등의 다양한 손상을 일으킬 수 있는 잠재성이 존재함으로[31], 이를 위해 많은 개체수를 이용한 추가적인 연구도 수행할 필요가 있다.
반추위 미생물 발효조절과 메탄저감을 목적으로 사용하고자 하는 생균제는 화학제제나 식물추출물에 비해 안정적이고 유망한 기술로 주목을 받고 있다. 미생물제제는 비교적 저렴한 생산비용과 생산성을 개선하는 효과로 인해 많은 연구자들의 주목을 받아왔다[32,33]. 현재 국내에서 보조사료로 이용하는 미생물제제는 30여 종 이상이나 대부분 성장 촉진 및 장내 발효 조절을 목적으로 사용하고 있으며, 메탄 저감을 위한 제제는 in vitro 실험 여건에서는 효과가 있으나 동물실험에서 지속적인 효과를 나타내지 못하여 여전히 논란의 여지가 있다. 한 예로 효모(Saccharomyces cerevisiae)가 소의 메탄 감소에 미치는 영향을 조사한 메타분석에서는 메탄 배출 및 메탄 저감효과가 미비한 것으로 나타났다[34]. 또한 가축에서 많이 사용하는 유산균은 발효 품질을 개선하기 위한 목적으로 많이 사용되며, 특히 사일리지 제조과정에서 저장성 개선 및 소화율 등을 위한 품질 향상을 목적으로 많이 사용하고 있다. 유산균은 발효과정가운데 2차 대사산물로 젖산, 아세트산, 에탄올, 프로피온산과 같은 발효생성물이 만들어진다. 이들 물질은 병원균의 성장을 억제할 뿐만 아니라 사일리지와 반추위내 프로피온산 생성을 통해 메탄 감소에 영향을 미치는 것으로 나타났다[35]. Enterococcus종은 in vitro상에서 메탄 발생량을 20.3% 감소시켰으며, 총 휘발성 지방산과 초산에는 영향을 미치지 않았으나 프로피온산이 감소하고 낙산은 25.7% 증가한 것으로 나타났다. 그러나 프로피온산을 생산하는 미생물이나 유산균도 사료에 급여하였을 때 동물 실험에서 메탄 저감 효과는 나타나지 않는 것으로 보고되었으며, 지금까지의 연구에서는 전체적으로 5% 미만이 저감효과가 있는 것으로 메타분석을 통해 보여주고 있다. 최근 온실가스 저감을 위한 연구에서 메탄영양세균(Methanotrophic bacteria)은 메탄을 탄소 및 에너지원으로 활용하는 독특한 특징을 가지고 있으며, 이 세균은 methylotrophic 균의 하위그룹으로 강, 논, 토양 및 슬러지 등 여러 환경에서 살고 있다. 논과 같은 자연환경에서는 메탄 생산, 산화 및 배출과정을 통해 메탄이 전환되는데, 생산된 메탄의 많은 부분이 메탄영양세균에 의해 분해되는 것으로 보고되어 있어 반추 가축에서의 메탄영양세균에 의한 메탄 저감 효과를 연구할 필요성이 있다[36]. 또한 미생물제를 급여할 때 메탄 저감효과에 대한 다양한 결과는 사료의 구성, 실험기간, 동물의 품종 등과 같은 다양한 변수에 따라 다르게 나타날 수 있으므로, 미생물 급여에 따른 효과가 발생하기 위해서는 체계적인 연구 설계와 많은 추가 연구가 필요하다.
표적 물질을 대상으로 하는 화학적 첨가제의 개발은 오랜 기간을 통해 연구가 진행되어 왔다. 그 중에서 반추위 메타생성균을 억제하는 3-NOP(3-니트로옥시프로판올)는 메탄 생성의 마지막 단계를 촉매하는 methyl-coenzyme M reductase 활성 부위에서 작용한다. 본 물질은 메탄 억제 간의 선형적인 관계를 보이며, 반추위내 일일 메탄 배출량의 32.5%를 감소시킨다. 3-NOP의 항메탄 생성 효과는 우선적으로 제제의 용해도가 높아 반추위내 체류 시간이 짧은 것으로 알려져 있기 때문에, 하루에 1–2회 정도 지속적으로 급여할 수 있는 급여시스템이 필요한 것으로 나타났다[37]. 또한 반추위내 에너지 밀도가 높은 프로피온산의 증가를 가져오는 반면에 과잉의 수소(H2)가 생성되는 특성을 지니고 있다.
화학제제로서 질산염 보충은 반추위내 메탄 저감 효과가 있는 것으로 알려져 있다(Table 2). 특히 질산염을 보충할 경우 반추위내 수소 이용성을 감소시키고, 메탄생성균을 포함한 Selenomondales 및 Campylobacterales 계통군에 영향을 줌으로써 메탄저감효과가 나타나는 것으로 보고되고 있다. 질산염은 이전 실험 결과에서 2.1%–3.04%까지 급여하였을 때 우유 생산, 사료섭취량 및 체중 증가에 영향을 미치지 않는 것으로 나타났다. 그러나 일부 연구에서 메탄 생성을 줄이기 위하여 많은 양의 질산염을 사용하면 암모니아로 불완전한 환원이 되어 반추위벽을 통해 질산염과 아질산염이 혈액으로 흡수되며, 혈액내 아질산염은 헤모글로빈과 결합하여 메트 헤모글로빈으로 전환함으로 질산염 중독의 원인이 될 수 있다. 또한 일부 분뇨로 배출되면 암모니아 및 아산화질소로 전환되어 분뇨내 온실가스 증가 원인이 될 수도 있으며, 질산염 중독은 사료 섭취, 생산량 감소, 호흡 불량, 청색증 및 폐사 등 여러 질환의 원인이 될 수 있다. 따라서 질산염 공급 시에는 반추위내 분해 속도를 낮추거나, 지속적으로 적응시킴으로 독성의 위험을 낮추는 방안도 제시되고 있다.
| Experimental period (days) | Methane production (g kg−1 DMI d−1) | Nitrate supplementation | Methane reduction rate (%) | References | |
|---|---|---|---|---|---|
| Control | Treatment | ||||
| 90 | 19.4 | 16.2 | 2.1% | 16.5 | [57] |
| 54 | 25.7 | 16.6 | 0.88 g/kg−1BW | 34 | [58] |
| 92 | 18.7 | 12.6 | 2.7 | 33 | [48] |
카르복실산 폴리 에스테르 이온 운반체인 모넨신은 그람 양성균을 억제할 뿐만 아니라 프로피온산을 향상시키는 제제로 축우에서 사용되며, 지속적으로 사용된 모넨신의 메탄 저감 효과는 여러 논문을 통해 잘 나타나고 있다. 메타 분석에 따른 모넨신의 메탄 저감량은 일일 17.5 g 감소하는 것으로 나타나며, 사료 1 kg당 23–44 g을 사용할 때 일일 25.6 g 감소되는 것으로 나타났다[38].
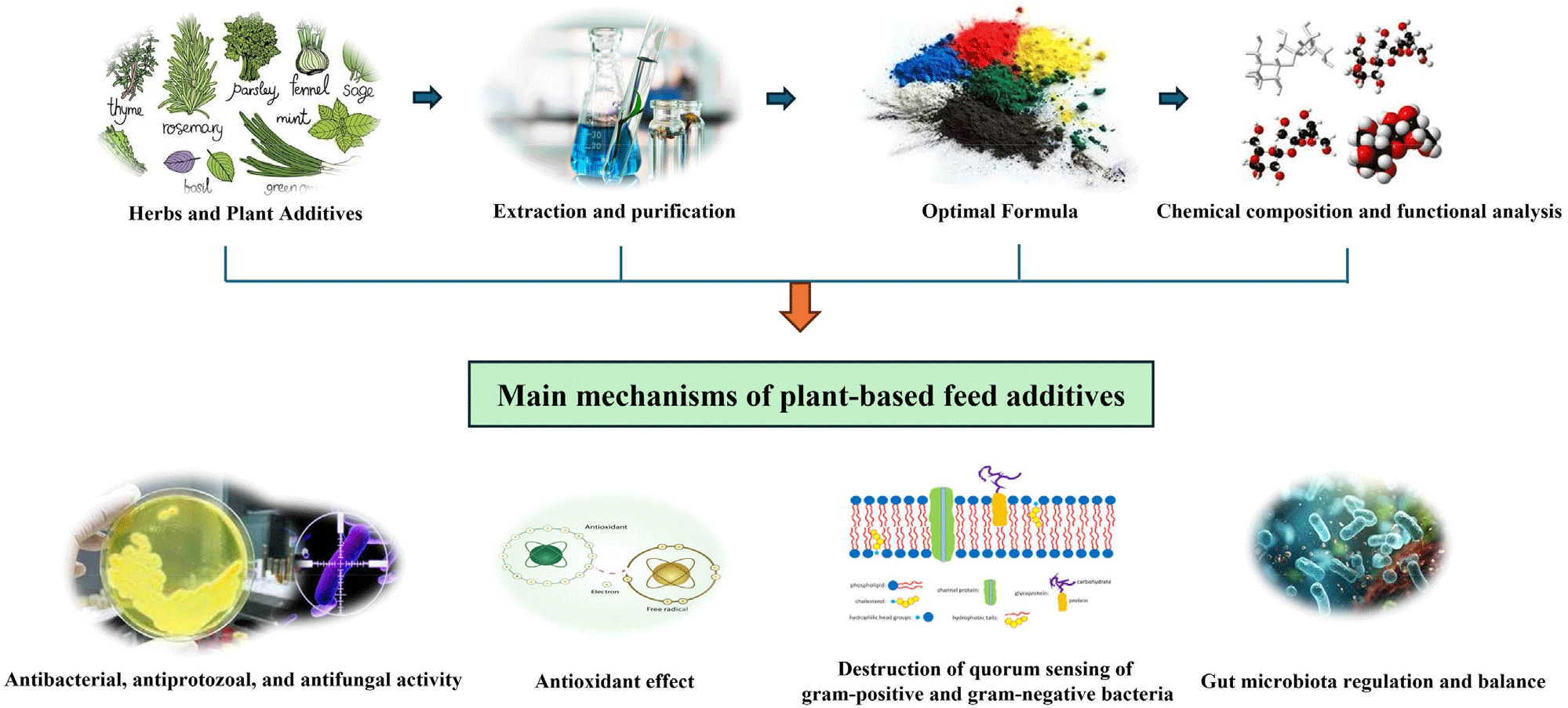
식물성 추출물 및 식물성 사료첨가제는 성장 촉진용 항생제와 유사한 특성을 가지고 있으며, 다양한 생물학적 활성을 가지는 복합 화합물의 특성을 가지는 물질이다[39]. 에선셜 오일과 같은 식물 추출물이나 허브 추출물은 성장이나 사료 효율에 부정적인 영향을 주지 않으면서 항균, 항산화, 항염증 및 면역 활동에 유익한 효과를 주며, 화학 제제에 비해 부작용이 적은 점이 장점으로 제시되고 있다. 식물 첨가제의 주요 유효성분으로는 글루코사이드, 폴리페놀, 다당류, 테르페노이드, 알칼로이드 및 플라보노이드 등의 있으며, 주요 2차 활성 대사산물로는 알칼로이드, 배당체, 페놀산, 사포닌, 탄닌, 테르펜 및 스테로이드 등이 포함된다. 이들 물질들은 다양한 추출 및 정제 방법을 통해 분리하여 기능에 맞는 첨가제로 사용되고 있다(Fig. 2).
반추가축에서 특정 성분의 식물 추출물과 복합 식물 첨가물은 반추위 발효 개선 및 암모니아를 억제하고 메탄을 저감하는 목적으로 사용되며[40], 그 중 탄닌, 사포닌, 에션셜 오일 및 폴리페놀은 반추위 발효 조절 및 메탄을 억제하는 것으로 나타났다[41,42]. 식물추출물의 주요 기능으로는 그람 음성균과 양성균에 대한 광범위한 항균 작용을 나타내는 것이며, 주요 병원성 미생물인 Salmonella auresu, Brachyspira hyodysenteriae, Escherchiia coli, Stapylococcus aureus 및 Pseudomonas aeruginosa 등에 대하여 항균 활성을 가지고 있다[43]. 식물추출물에 포함된 대부분의 활성 물질은 소수성으로 세균의 세포막과 인지질의 이중층 구조를 손상시켜, 막 투과성을 증가시킴으로 삼투압 조절과 세포 대사과정을 중지시키거나 DNA 또는 RNA polymerase의 활성을 억제하는 것으로 알려져 있다[44]. 이외에도 면역 조절과 항산화 활성을 가지고 있는 다양한 식물 활성 추출물은 장내 미생물 균총 조절에도 기여한다. 그 중 마늘, 페퍼민트 및 폴리페놀이 함유된 물질들은 박테리아의 다양성을 증가시키고, Salmonella spp., E. coli 및 Campylobacter를 포함한 병원성 세균의 수를 감소시킨다. 또한 상업용 제품인 Mootral에 포함된 마늘 분말과 감귤 분말 혼합물은 프로피온산 생성을 증가시키고 수소 생산 박테리아를 감소시키며[45], 에센셜 오일-코발트 및 약초 혼합물은 반추위 발효 및 고세균 군집을 조절하여 메탄과 암모니아를 감소시키는 효과를 가져왔다[46,47].
캐슈넛 껍질액(Cashew Nut Shell Liquid, CNSL)은 캐슈넛 생산에서 나오는 부산물로 항균 활성을 가진 페놀성 화합물인 아니카르드산, 카르다놀 및 카르돌이 포함되어 있으며, 아나카르드산이 주요 성분이다. 이 물질은 미생물의 세포벽을 파괴하는 계면활성제 활성을 나타내며, 더불어 프로피온산 생산을 증진시켜 메탄을 감소시키는 데 작용한다. 젖소에서 CNSL을 급여할 경우 메탄 배출이 최대 38%(CH4 g/kg DMI)까지 감소하였으며, 주요 메탄균인 Methanobrevibacter의 풍부도가 감소하였다. CNSL의 사용도 화학 제제와 마찬가지로 주요 성분인 아나카르드산이 안정성 및 효과를 높이기 위해서는 메탄 저감 효과가 있는 물질과의 혼합 사용도 고려할 필요가 있다[48,49].
가축의 유전적 개량
반추 가축의 메탄 완화를 위한 전략 중 메탄을 적게 배출하는 가축을 선발하는 방안은 축산 농가의 비용 절감과 향후 지속 가능한 축산 환경 구축 및 기후 변화에 대응하는 방법으로 제시되고 있다. 메탄 발생량이 적은 반추 가축을 생산하려면 장내 메탄 배출이 낮은 유전적 잠재능을 가진 동물을 선발하여야 하며, 반추 가축 중에 젖소는 일일 약 426–463 g의 메탄을 생산하는 것으로 보고된다[50]. 젖소는 메탄 생성과 관련하여 중간 정도의 유전성을 가지고 있는 것으로 나타났으며, 유전적인 측면에서 메탄 생산량은 약 0.12–0.45까지 유전될 수 있기 때문에 젖소를 선발하는데 유전 육종 방법을 사용하는 것은 지속적인 낙농 산업을 유지하기 위한 수단이 될 수 있다[51]. 젖소의 메탄 배출량 추정치에 대한 유전력은 착유 기간 동안 다양하여 비유초기에는 0.23에서 비유중기에는 0.3으로 상승하고 후기 0.27로 나타나며 평균 유전율은 약 0.27로 다양한 것으로 보고되고 있다[52]. 캐나다에서는 2023년부터 젖소 품종에 대하여 유생산에 영향을 주지 않고, 메탄 배출이 적은 개체를 선발하기 위한 평가 방법이 시행되었다. 본 유전자 평가 모델에는 우유 생산량, 지방 생산량 및 단백질 생산량과 함께 메탄 발생량에 대한 상관 관계를 고려한 평가 모델이 사용되었다. 젖소의 생산성을 중심으로 한 개량 방법 외에도 소의 게놈 정보를 활용한 가축의 선발도 대안이 될 수 있다. 이는 최근 연구에서 메탄 생산과 관련된 가변성 다유전적 특성이 입증되고, 단일 뉴클레오타이드 다형성 및 메탄 특성과 관련된 후보 유전자가 보고되고 있다[53,54]. 젖소에서 발생하는 메탄 측정은 일반적으로 스니퍼(Sniffer) 방식을 활용한 측정 방법이 많이 사용되며, 이 방식은 착유중인 젖소로 부터 방출되는 메탄 가스를 직접 측정하는 방법이다. 젖소의 코와 입 주변에서 가까운 위치에 기계를 설치하여 메탄과 이산화탄소의 농도를 동시에 측정하는 방식으로, 다수의 착유 중인 젖소의 메탄 발생량을 측정할 수 있다. 이외에도 젖소의 선발에 적외선 분광법(Mid-infrared[MIR] 또는 Fourier Transform MIR) 방법을 통해 메탄 발생량을 예측하는 연구도 진행된 바 있으며, 적외선 분광법은 우유의 성분을 분석하는 기술로 적외선은 분자의 진동에너지를 흡수하는 특성을 가지고 있다. 이를 이용하여 우유 MIR은 우유, 지방, 단백질 생산량, 계절, 연령 및 착유 일수를 주요 변수로 포함하여, 다양한 요인들을 메탄발생량과 연결하여 메탄 효율성이 높은 개체를 선발하고 정량적으로 분석할 수 있다[55].
결론 및 향후 과제
반추 가축은 식량 안보와 인간의 정상적인 영양 균형을 위한 중요한 보급원으로서, 우리가 생산하는 고기 및 우유는 고품질 단백질과 필수 미네랄 및 비타민의 주요 공급원으로 이용되고 있다. 또한 반추 동물의 장점은 사람이 이용하지 않는 조사료와 부산물을 사료로 사용할 수 있다는 이점이 있다. 반추 가축을 생산하기 위한 영양 대사 과정 중에 발생되는 메탄은 반추위의 대사과정에서 생성되는 정상적인 발효 산물이다. 또한 반추동물의 고기와 우유 단백질을 생산하기 위한 탄소 발자국은 일반적으로 식물성 단백질에 비교하여 탄소발자국이 높은 것으로 알려져 있으나, 아미노산의 품질을 고려하면 탄소 발자국은 최대 40%까지 감소되는 것으로 나타났다[56].
국가별 환경 규제가 점차 강화됨에 따라 우리 축산업은 지속적인 혁신과 개선을 외부로부터 강요 받고 있으며, 지구 환경을 보존하는 측면에서 온실가스와 암모니아 배출을 줄이는 것은 기본적인 의무가 되어가고 있다. 그 중 주요 온실가스인 메탄 배출을 완화하는 것은 지구 온난화를 감소시킬 수 있는 방안으로, 2000년 이후 반추 가축의 장내 메탄을 줄이기 위한 연구가 수십 년 동안 진행되고 있다. 다년간의 연구를 통해 반추 가축의 메탄 저감을 위한 다양한 노력은 상당한 진전을 이루었으며, 대부분의 개발된 저감제는 반추위에 존재하는 메탄생성균을 표적으로 삼거나 발생되는 수소의 이용을 개선시키는 방향으로 진행되어 왔다. 또한 최근에는 반추위에 발생되는 메탄을 이용하는 미생물에 의해 저감시키는 방안도 새로운 대안으로 제시되고 있다.
이처럼 반추 가축에서 발생하는 메탄 저감을 위한 다양한 방안이 제시될 필요가 있으며, 효과적인 메탄 감축을 위해서는 여러 기술을 접목해야 한다. 하지만 메탄 저감제의 개발과 더불어 안전성 확보가 최근 해결해야 할 문제이며, 이는 동물과 인간의 건강을 위하여 우선적으로 고려되어야 한다. 안전성 확보를 위한 단계적 독성 실험, 사용 기준 및 제한에 대한 기준을 마련하고 안전 사용에 대한 지침도 제공해야 할 것이며, 안전하고 지속적인 환경 친화적인 가축 생산을 위해서는 연구자, 축산농가 및 사료 회사가 모두 함께 노력해야 한다.