서론
난자는 난소의 난포에서 난모세포로부터 감수분열을 겪으며 성숙되는 과정을 거쳐 배란되고, 정자와 만나 수정란으로 발달된다. 난포에서 난모세포는 성숙하는 동안 세포주기 조절과 같은 다양한 기능을 하는 단백질 및 수정 후 배발달에 필요한 복합적 요소들이 난자의 세포질에 축적한다. 그러므로 난자의 질에 따라 수정 후 배발달의 잠재력에 영향을 미치는데, 양질의 난자는 분자생물학적으로 충분한 물질을 합성하여 성숙하고, 수정 후 정상적인 배아 발달을 나타낸다[1]. 이에 반하여 질적으로 좋지 않은 난자는 다정자수정(polyspermy)으로 인한 수정란의 발생학적 문제나 착상 후 낙태까지 야기할 수 있다. 또한 체외성숙(in vitro maturation)과 체외수정(in vitro fertilization) 시 난자의 환경적인 요인들이 수정 후 배아 발달과 착상 후 태아의 발육과 관련이 높은 것으로 보고되고 있다[2,3].
돼지의 난자는 체외수정, 체세포핵이식(somatic cell nuclear transfer), 정자미세주입법(intracytoplasmic sperm injection) 및 형질전환돼지(transgenic pig)의 생산 등에 많이 사용되고 있다. 그러나 이러한 기술들은 난자 자체에 대한 분자생물학적 정보가 불분명하기 때문에 낮은 효율성과 대리모에 이식 후 비정상적인 발달과 같은 한계를 나타내고 있다. 그러므로 좀더 실용성을 높이기 위해서는 돼지 난자의 질을 조절하는 분자들의 규명과 함께 난모세포의 질적인 특성을 이해하는 것이 필요하다[4–6]. 많은 실험실에서 난자의 질과 발달을 개선하기 위하여 체외성숙 시 배지에 다양한 물질이나 호르몬 등을 보충하기도 한다[7,8]. 또한 난소의 난포로부터 양질의 난자를 다수 회수하려고 시도하기도 한다[9–11]. 그러나 이러한 시도들은 방법의 복잡성과 첨가물질들의 기능적 불분명성 등에 의해 실질적으로 양질의 난자를 생산하는 데 제한적일 수 있다.
여러 동물들에서 난자의 질을 판단하는 데 있어서 우선적으로 난포직경과 배아발달 능력에 대해서 광범위하게 연구되어 왔는데, 그 결과로 직경이 상대적으로 큰 난포에서 회수한 난자들이 성숙도와 발달율이 높은 것으로 나타났다[12–15]. 또한 충실한 모양의 난자난구세포 복합체(cumulus-oocyte complexes, COCs)가 성숙도와 배아발달 결과에 좋다는 연구도 발표되었다[16–18].
난소의 난포로부터 회수된 양질의 난자난구세포 복합체는 형태학적으로 3개 이상의 난구세포층이 치밀하게 난자를 둘러싸고 있고, 이러한 난구세포층은 난자의 성숙과정에 다양한 기능을 하여 난자의 질에 직접적으로 영향을 미치게 된다. 난구세포층이 하나 또는 두 개로 이루어져 있거나 느슨하게 결합되어 있는 상태의 난자난구세포 복합체는 난자를 충분히 성숙시키지 못하므로 비정상적인 것으로 구분한다. 돼지 난구세포층은 난자성숙 시 팽창되면서 난자의 감수분열 진행, 수정 및 배아발달과 높은 상관관계가 있다고 알려져 있다[19]. 따라서 난자의 성숙 메커니즘을 이해하기 위해서는 난자난구세포 복합체에 대한 상세한 기능 연구가 필요한 것으로 보인다.
따라서 본 연구에서는 돼지의 난자난구세포 복합체를 형태학적으로 구분하고, 이들간의 단백질의 발현 차이를 조사하기 위해 2차원 전기영동과 matrix-assisted laser desorption ionization- time of flight(MALDI-TOF) 분석을 수행하였다.
재료 및 방법
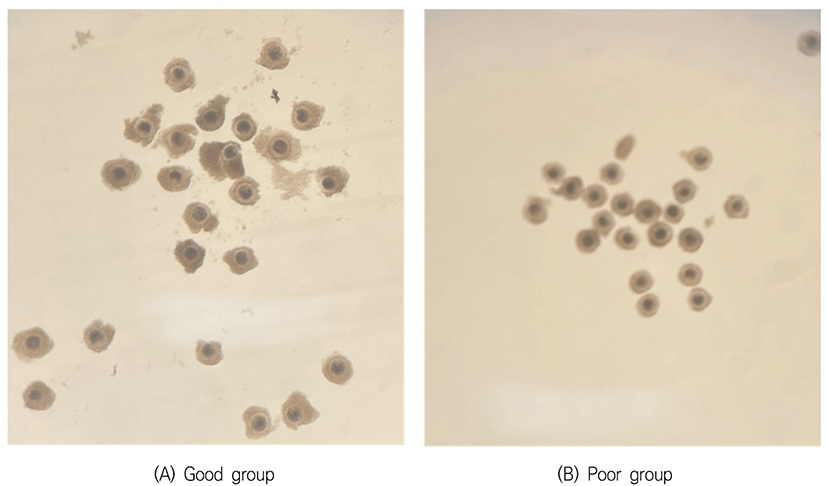
37°C의 생리식염수가 들어 있는 보온병을 이용하여 도축장에서 난소를 채취한 후, 보온병에 넣어 실험실로 운반하였다. 난소를 생리식염수로 2–3회 세정한 후 멸균여과지로 수분을 흡수시키고, 18 gauge 주사바늘이 연결된 10 mL 주사기로 직경 2–8 mm의 난포에서 난자를 흡인하였다. 흡인된 난자를 포함된 난포액을 100 mm dish에 놓고 실체현미경 하에서 난구세포에 둘러싸인 난자난구세포 복합체를 선별하였다. 회수된 난자난구세포 복합체의 난구세포층을 기준으로 충실한 그룹과 빈약한 그룹을 분류하였는데, 양질의 그룹(good 그룹)은 난구세포층이 3층 이상이며, 치밀한 구조로 이루어진 것이고, 저질의 그룹(poor 그룹)은 난구세포층이 2층 이하인 것으로 빈약한 구조를 나타낸 것으로 구분하였다(Fig. 1).
각 그룹별로 약 1,000개 난자를 SDS sample buffer(1% SDS, 7M urea, 2M thiourea, 4% w/v CHAPS, 40 mM Tris, 0.1 M DTT and protease inhibitor)로 100 μL로 부유시키고, 1 mM PMSF와 1× protease inhibitor로 첨가한 후 초음파분쇄를 실시하였다. 그 다음 실온에서 1시간 가량 정치하였고, 15,000×g에서 20분간 원심분리를 실시하고, 상층액을 수집하여 endonuclease를 100 unit을 넣고 실온에서 30분간 정치하였다[20]. Bradford protein assay(Bio-Rad) 방법으로 단백질 정량을 한 다음 1 mg씩 나누어 담은 후 분석 시까지 −70°C에 냉동 보관하였다.
난자단백질 용액을 1 mg이 되도록 준비하며, 2% IPG로 처리하여 modify buffer(7 M urea, 2 M thiourea, 4% CHAPS, 2.5% DTT, 10% isopropanol, 5% glycerol, 2% v/v IPG buffer; pH 3–10)로 총 350 μL가 되도록 조절하였다. 준비된 샘플을 rehydration tray에 넣고 IPG strip(pH 3–10; 180 × 3 × 0.5 mm)에 기포가 없도록 하고 그 위에 oil을 덮고 12시간 정치시켰다. IPG strip을 3차 증류수로 한 번 씻은 후 물기를 잘 닦고, gel 부분이 위로 향하게 하고, strip 음전하방향 끝 1 cm 정도에 IEF electrode strip을 3–4 cm로 잘라 물에 적신 후 물기를 제거한 것을 겹쳐 놓는다. 양전하 방향 끝은 0.4% DTT를 적신 IEF electrode strip을 겹쳐 놓는다. 이후 oil로 덮은 다음 집게로 IEF electrode strip과 paper가 strip에 잘 붙도록 겹쳐진 부분을 살짝 눌러주고, 50 V로 100분, 100 V 100분, 300 V 100분, 600 V 100분, 1,000 V 100분, 3,000 V 100분, 5,000 V 100분 및 8,000 V 100분으로 전기영동을 실시하였다. 1차 전기영동을 실시한 strip을 equilibration buffer(6 M urea, 2% SDS, 50% v/v glycerol, 2.5% acrylamide, 1.5 M Tris-HCl; pH 8.8)에 Isopropanol 474 μL를 넣은 다음 15분간 정치하고, equilibration buffer에 DTT를 1% 넣어 15분간 처리하였다. Equilibration된 strip의 물기를 제거한 후 미리 만들어진 8%–16% gradient gel에 기포 없이 strip을 넣고 stacking gel을 부어 넣어 strip을 고정하였다. DALT system에 SDS running buffer를 채우고, gel당 10–15 mA로 12시간 정도 전기영동을 실시하였다. SDS-PAGE가 끝난 gel을 분리하여 증류수에 넣었다가, 물기 제거한 다음 고정용액에 1시간가량 두었다. 고정용액을 제거한 다음 Coomassie blue염색액을 넣고 24시간 이상 염색한 다음 scanner를 이용하여 gel image의 scan을 실시하였다. 얻어진 image는 ImageMaster 5.0 소프트웨어를 이용하여 gel 중 각 spot들의 발현차이를 분석하였다.
Gel image에서 발현차이를 보이는 spot를 gel에서 떼어낸 다음 washing solution을 이용하여 distaining한 다음 진공건조기를 이용하여 gel을 말린 다음 trypsin solution 5 μL를 넣고 30분 뒤에 25 mM NH4HCO3 5 μL를 넣고 37°C에서 12–16시간 처리하였다. 나머지 solution을 제거한 후 5 μL의 Extraction Buffer를 넣고 수중초음파(Water Sonic)에서 38°C에서 30분–1시간 동안 sonication하여 trypsin에 의해 나온 peptide를 추출하였다. 추출된 peptide 용액은 MALDI-TOF를 실시하였는데, Mass spectrometric 분석은 Voyager-DE STR MALDI-TOF-MS(PerSeptive Biosystems, Framingham, MA, USA)를 이용하여 peptide mass fingerprinting sample 자료를 수집하였다. 펩타이드 자료는 DataExplorer™ 소프트웨어를 이용하여 peak 데이터를 수집하여 온라인 단백질서열 데이터베이스에서 검색하였다(SWISS-PROT and/or NCBI [2010/02/01, Data Bank]).
결과 및 고찰
돼지 난소난포로부터 회수한 난자난구세포 복합체(COCs)를 난구세포층을 기준으로 양질의 그룹(good)과 저질의 그룹(poor)으로 분류하여 단백질을 추출한 후 gel당 단백질 1 mg씩을 loading 하여 제1차 multiphorⅡ와 제2차 SDS-PAGE로 전기영동을 실시하였고, 전기영동 젤을 Coomassie blue로 염색하여 COCs 단백질의 2차원 gel image를 얻을 수 있었다(Fig. 2). 각각의 단백질들은 등전점과 분자량에 따라 분리되어 gel image에서 단백질 스팟으로 분포되어 있는 것을 확인할 수 있었다. 이 image들을 ImageMaster 5.0 소프트웨어를 이용하여 분석한 결과, 각 gel에서 약 300개 이상의 단백질 스팟들이 존재하는 것으로 나타났다. 양질의 그룹과 저질의 그룹(poor) 단백질 스팟들에 대해 통계분석을 실시하여 그룹간에 발현차이를 보이는 단백질 스팟들을 선별하여 퍼센트 볼륨과 그들의 평균값을 Fig. 3에 표시하였다. Good 그룹과 poor 그룹의 COCs 발현 차이를 보이는 단백질 스팟에 대한 분석에서 모두 5개의 스팟이 1.5배 이상의 차이를 나타내었는데, 그 중에서 5개의 단백질 스팟 모두가 양질의 그룹에서 더 많이 발현되는 것으로 분석되었다.
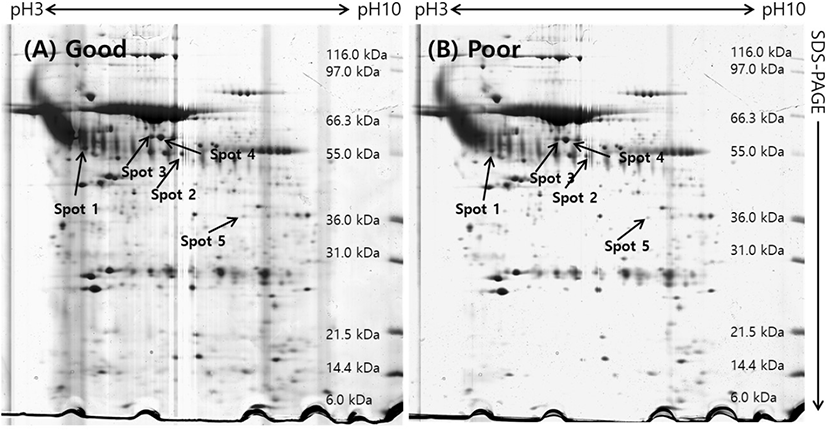
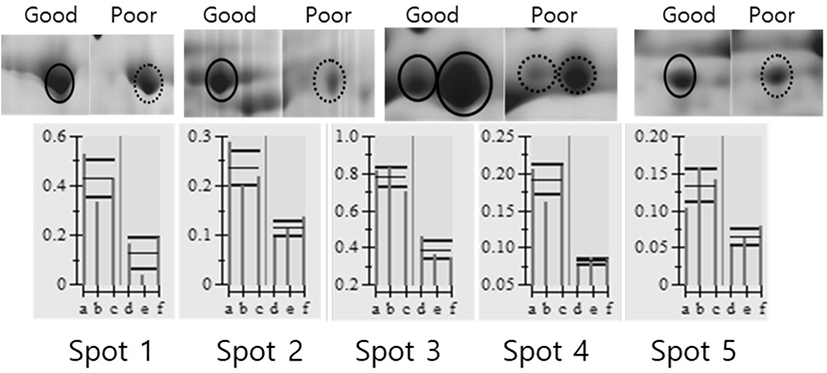
발현에 차이가 나는 단백질 스팟들이 어떤 단백질인지를 판단하기 위해 단백질 스팟을 gel에서 도려내어 트립신으로 처리하여 peptide 상태로 만든 다음 MALDI-TOF/MS를 실시하였고, DataExplorer™ 소프트웨어로 peptide masses 데이터를 수집하여 검색소프트웨어 ProFound (http://prowl.rockefeller.edu/prowl-cgi/profound.exe)에서 단백질을 검색하였다. 이러한 과정을 통해 동정된 단백질은 Table 1에 보여주고 있다. 동정된 단백질들은 Transferrin, include tight junction protein ZO-2, tubulin beta chain, Meiosis-specific nuclear structural protein 1 그리고 Similar to dynamin 1-like isoform 4로 나타났다.
이들 단백질의 주요한 기능으로는 세포의 물질수송과 관련된 것과 세포구조 성분 등으로 나타났다. Tight junction protein ZO-2는 이온, 물 용액이 세포 내 경로를 통과하는데 조절하는 기능을 가지고 있으며, 지질과 단백질의 움직임을 조정할 수 있는 것으로 알려져 있다. 난자에서는 세포의 분화, 증식 및 극성에 영향을 미치는 신호분자를 긴밀하게 결합하는 것을 볼 수 있다[21,22]. Tubulin beta chain은 미세관의 주요한 성분으로 알려져 있으며, 난자의 초기 배아성숙에 핵심적인 역할을 한다[23]. Meiosis-specific nuclear structural protein 1은 감수분열-특정 구조단백질로 감수분열 시 재조합 조절을 통한 생식분열과 세포분화 조절에 역할을 한다고 알려져 있다[24]. Similar to dynamin 1-like isoform 4는 미토콘드리아와 과산화소체들의 분열에 중요한 역할을 하는 것으로 보고되고 있다[25]. 이 결과들로 돼지의 난자난구세포 복합체 단백질발현 양상을 확인할 수 있었는데 양질의 COCs와 비정상의 COCs 사이에 차이나는 단백질들은 난자의 성숙과정에 필요한 기능과 구조물에 영향을 미치는 것으로 규명되어, 난자 발달과 직접적으로 관련 있는 단백질로 판명되었다. 본 연구에서 정상 COCs와 비정상 COCs 간에 차이나는 이러한 단백질을 동정하고, 단백질분자의 특성과 기능에 정보를 얻었지만, 아직 동정되지 않은 소량으로 존재하는 단백질들이 있을 것으로 예상되며, 이들을 동정하고 기능을 규명하는 노력과 함께 여기서 동정된 단백질들을 활용하여 손쉽게 정상적인 COCs를 구분하는 방법들의 개발 등에 대한 향후 연구가 필요하다.
