서 론
사료 중 대표 잔류·오염물질로는 농약, 동물용의약품, 곰팡이독소 등이 있다. 농약은 곡류와 같은 식물성 원료에 잔류하고 있을 가능성이 높으며, 동물용의약품의 경우 동물성 원료에 잔류할 가능성이 높다[1]. 농약과 동물용의약품이 과도하게 잔류할 경우, 동물의 건강에 심각한 영향을 미칠 수 있다. 농약 잔류물질은 동물에게 신경계 및 생식 건강에 부정적인 영향을 미칠 수 있으며, 동물용의약품의 경우 항생제 내성 발생을 촉진하고 호르몬 균형을 교란시킬 수 있다. 또한 반려동물 사료에 잔류 농약이 존재할 경우, 면역체계의 약화, 소화불량 등 건강 문제를 유발할 수 있으며, 이들은 장기적인 노출에 의해 더욱 심각해질 수 있다[2]. 특히 양축용사료와 다르게 반려동물 사료에는 단백질류와 같은 동물성 원료가 많이 혼합되어 있기에 관리가 필요하다. 국내에서 사용되는 사료 원료의 경우 대부분 수입되고 있으며, 최근에는 반려동물용 배합사료의 수입비율이 높아지고 있다[3]. 이에 국내에서 다양한 잔류오염물질에 대해 잔류허용기준을 설정하고 관리를 하고 있다. 하지만, 나라별로 등록 및 사용하는 농약과 동물용의약품이 다르며, 기준도 다르게 설정되어 있다[4]. 또한 수입되는 원료는 수입국가의 기후에 따라, 선적 기간에 따라 곰팡이가 발생할 가능성이 있고, 이는 여러 독소를 발생시킬 수 있다. 이에 국내 관리대상 성분 이외의 물질들이 사료에 잔류하고 있을 가능성이 있다[1,5].
국내에서는 이러한 물질들의 안전관리를 위해 기준을 설정하고 대상성분들을 정성 및 정량 할 수 있는 분석방법들을 개발하여 활용하고 있다. 잔류농약 102성분 분석을 위해 질량분석기를 활용한 동시분석방법을 개발하여 적용하고 있으며, 동물용의약품은 8성분을 분석하기 위해 LC(liquid chromatography) 및 GC(gas chromatography), 질량분석기를 활용한 6개 분석법을, 곰팡이독소는 11성분에 대한 질량분석기를 활용한 동시분석방법을 각각 활용하고 있다[6]. 이에 잔류·오염물질을 모두 확인하기 위해서는 한 시료당 여러 방법을 적용해야 한다. 이 때문에 분석 시 많은 시약과 용매, 시간이 소모된다. 또한 해당 분석방법은 분석 대상이 국내 기준설정 물질들에 한정되어 있다. 수입원료 및 배합사료 모니터링에 활용하기 위해서는 이외의 더 많은 성분들을 추출하고 분석할 수 있는 다성분 동시분석방법이 필요하다. 또한 이러한 모니터링을 지속적으로 수행하기 위해서는 시간이나 비용적인 부분에서 더 효과적인 분석방법이 필요하다.
현재 이러한 유해물질을 추출하기 위한 방법으로 QuEChERS 분석법이 널리 사용되고 있다. QuEChERS 분석법은 유기용매층을 물층과 분리하여 분석하므로 상대적으로 비극성인 물질들의 추출에 효율적이다. 이 전처리방법은 최근까지도 잔류농약, 동물용의약품 소수 계열, 곰팡이독소 분석에 많이 사용되어 왔다[6]. 많은 잔류오염물질들이 QuEChERS를 활용하여 분석가능하였지만 극성 잔류농약이나, 일부 잔류 물질들은 여전히 분석하기 어려움이 있었다. 특히 동물용의약품의 경우 질병예방 및 치료 용도에 따라 다양한 계열이 있으며, 각 계열은 상이한 물리화학적 특성을 보여 효과적인 전처리방법이 다르게 나타나고 극성이 큰 잔류농약 보다 더 강한 극성을 띄는 성분들이 다수 존재한다. EU에서는 극성잔류농약을 분석하기 위해 메탄올과 완충제를 기반으로 추출하는 QuPPe 분석법을 개발하여 활용하고 있다[7]. 해당분석법은 아세토니트릴 보다 더 극성 용매인 메탄올을 추출용매로 사용하고 있으며, 해당 용매는 시료 추출 시 작물에 존재하는 수분과 혼합된다. 이에 상대적으로 더 극성이거나 친수성인 물질들을 추출할 수 있게 된다. 본 연구실에서 수행된 사전 연구에서도 QuEChERS를 활용하여 잔류농약 197 성분, 동물용의약품 56 성분, 곰팡이독소 5 성분을 동시 분석하는 방법을 개발하였다[7]. 또한 QuPPe 분석법을 응용하여 동물용의약품 30 성분을 분석하는 방법을 개발하였다[8]. 두 가지 분석방법은 추출용매의 극성차이를 두고 있으며, 이는 사료 대표 잔류오염물질인 농약, 동물용의약품, 곰팡이독소의 다양한 계열의 성분들을 추출하고 분석할 수 있음을 확인하였다[9,10].
본 연구에서는 국내 사료의 안전관리를 위해 본 연구실에서 개발된 두 가지 분석방법을 활용하여 분석대상범위를 크게 확대하였으며, (잔류농약 327성분, 곰팡이독소 7성분, 동물용의약품 121성분) 유효성 검증을 통해 정성 및 정량법으로서 신뢰성을 확보하였다. 그리고 분석법을 활용하여 국내 유통사료에 대한 모니터링을 수행하였다. 그리고 모니터링 결과 검출성분들의 잔류 및 물질 특성을 파악하여 물질의 독성, 노출 경로, 국내외 설정 기준, 사료별 잔류특성 등에 대해 조사하였다.
재료 및 방법
모든 표준물질은 Sigma-Aldrich(St. Louis, MO, USA), AccuStandard(New Haven, CT, USA) 및 Cfm Oskar Tropitzsch(Marktredwitz, Germany)의 제품을 사용하였다. Acetonitrile(ACN), methanol(MeOH) 및 water은 Merck(Darmstadt, Germany)로부터 구입하였다. 100 to 1,000 μg/mL pure standards의 개별 stock solutions을 ACN 또는 MeOH에서 제조하고 −20°C에서 보관하였다. 작업 용액은 각 stock solution을 ACN으로 필요한 농도로 희석하여 제조하였다. 분석에 사용된 모든 용매는 LC-MS(mass spectrometry) 등급이었다. 정제수는 Milli-Q system(Millipore, Bedford, MA, USA)을 통해 얻었다. Ammonium formate(HCOONH4), magnesium sulfate(MgSO4), sorbitol, sodium chloride, D-(+)-gluconic acid-δ-lactone, 3-ethoxy-1,2-propanediol, acetic acid 을 Sigma-Aldrich로부터 입수하였다. Formic acid(HCOOH) 및 shikimic acid은 Fisher Scientific (Pittsburgh, PA, USA)에 의해 공급되었다. Ethylenediaminetetraacetic acid(EDTA)은 Bioneer (Daejeon, Korea)에서 구입하였다. Bondesil primary secondary amine(PSA), Octadecylsilane(C18)은 Biotage(Uppsala, Sweden)로부터 제공받았다. 4 g of MgSO4, 1 g of NaCl, 1 g of Na3C6H5O7 and 0.5 g of Na2C6H6O7을 함유하는 QuEChERS salt mixture는 BEKOlut(Bruchmühlbach-Miesau, Germany)로부터 구입하였다. 시험에 사용된 Matrix-matched calibration materials 및 feed(corn and compound feed for livestock and pets)는 사료 공장 및 상점에서 구입하였으며, 대상 유해 물질이 없는 것을 확인하였다. LC-MS/MS 시스템 시 최종 용액의 pH는 matrix에 따라 달라질 수 있으므로 pH를 5로 조절하기 위해 buffer solution을 사용하였으며, 이는 일반적으로 농약 등의 유해물질에 안정한 buffer solution으로 100 mM ammonium formate aqueous solution(pH 4)을 사용하였다. Analyte protectant(AP)는 GC-MS/MS 시스템의 active sites와 강력하게 상호 작용하여 분석물의 분해, 흡착 또는 둘 다를 줄이는 데 사용되었다[11]. GC 분석을 위해, AP mixture는 다음과 같이 제조하였다. 먼저, 0.2 g of 3-ethoxy-1,2-propanediol, 2 mL of D-(+)-gluconic acid-δ-lactone stock solution, 1 mL of sorbitol stock solution 및 1 mL of shikimic acid stock solution를 Volumetric flask에 넣었다. Volumetric flask를 10 mL의 acetonitrile 와 water(7:3, v/v)로 채우고 4°C에서 보관했다. 사용하기 전에 이 용액을 5% formic acid를 함유한 acetonitrile(3:1, v/v)과 미리 혼합했다.
분석방법은 사료 중 다양한 계열의 물질들을 분석하기 위해 개발되었다. 이에 다양한 물질들에 대한 분석가능성 및 적용범위를 확인하기 위해 다양한 잔류농약, 동물용의약품, 곰팡이독소를 확보하여 분석법 적용 여부를 확인하였다. 잔류농약 327성분, 곰팡이독소 7성분, 동물용의약품 121성분에 대한 분석법 적용 및 모니터링을 수행하였다.
LC-MS/MS 분석은 Waters ACQUITY UPLC I-Class/XEVO TQ-XS 시스템(Waters, MA, USA)에서 수행되었다. 시료 분리에는 Acquity UPLC BEH(bridged ethyl hybrid) C18(100 × 2.1 mm, 1.7 μm)의 분석 컬럼이 사용되었다. 크로마토그래피 분리는 5 mM Ammonium formate 및 0.1% formic acid를 포함하는 물(용매 A)과5 mM Ammonium formate및 0.1% formic acid를 포함하는 메탄올(용매 B)을 사용하였다. 이원 이동상 시스템에서 multi-class hazardous materials analytical method 1은 0–1.0분 동안 10% B, 1.0–19.0분 동안 10%–95% B, 19.0–22.0분 동안 95% B, 22.0–22.1분 동안 95%–10% B, 22.1–25.0분 동안 10% B의 gradient를 사용하여 수행되었고, multi-class hazardous materials analytical method 2에서는 0–1.0분 동안 10% B, 1.0–6.0분 동안 10%–40% B, 6.0–10.0분 동안 40%-95% B, 10.0–15.0분 동안 95% B, 15.0–15.1분 동안 95%–10% B, 15.1–18.0분 동안 10% B의 gradient를 사용하여 수행되었다. 그 외 동일 조건에서 수행되었으며, 유속은 0.3 mL/min, 컬럼 오븐 온도는 45°C로 유지했다. 표적 분석물은 양이온 모드 또는 음이온 모드에서 전자 분무 이온화 소스(XEVO TQ-XS; Waters)가 장착된 삼중 사중극자 질량 분석기(triple quad, QqQ MS)에서 다중 반응 모니터링(multiple reation monitoring, MRM) 모드를 사용하여 측정되었다. 검출기 매개변수는 source temperature 150°C, desolvation temperature 온도 500°C, desolvation gas flow 700 L/h, cone gas flow 150 L/h였다. 유해 물질의 선택성 확보와 정밀한 정량을 위해 다중 반응 모니터링(MRM)이 수행되었다.
GC-MS/MS 분석은 GCMS-TQ8050 NX(SHIMADZU, Santa Clara, CA, USA)에서 수행되었다. 크로마토그래피 분리를 위해 Aglinet DB-5컬럼(30 m × 0.25 mm, 0.25 μm)을 사용하였고 인젝터의 온도는 280°C로 설정하였다. 헬륨을 운반 가스로 사용했으며 유속은 1.5 mL/min이었다. 오븐 온도는 처음에 90°C로 설정하고 3분 동안 유지한 다음 20°C/min의 속도로 최대 120°C까지 높였다. 그 후, 가열 속도를 8°C/min으로 300°C까지 더 올리고 3분 동안 유지했다. 질량 분석기는 MRM 모드에서 작동되었고, 이온 소스 온도는 230°C였다.
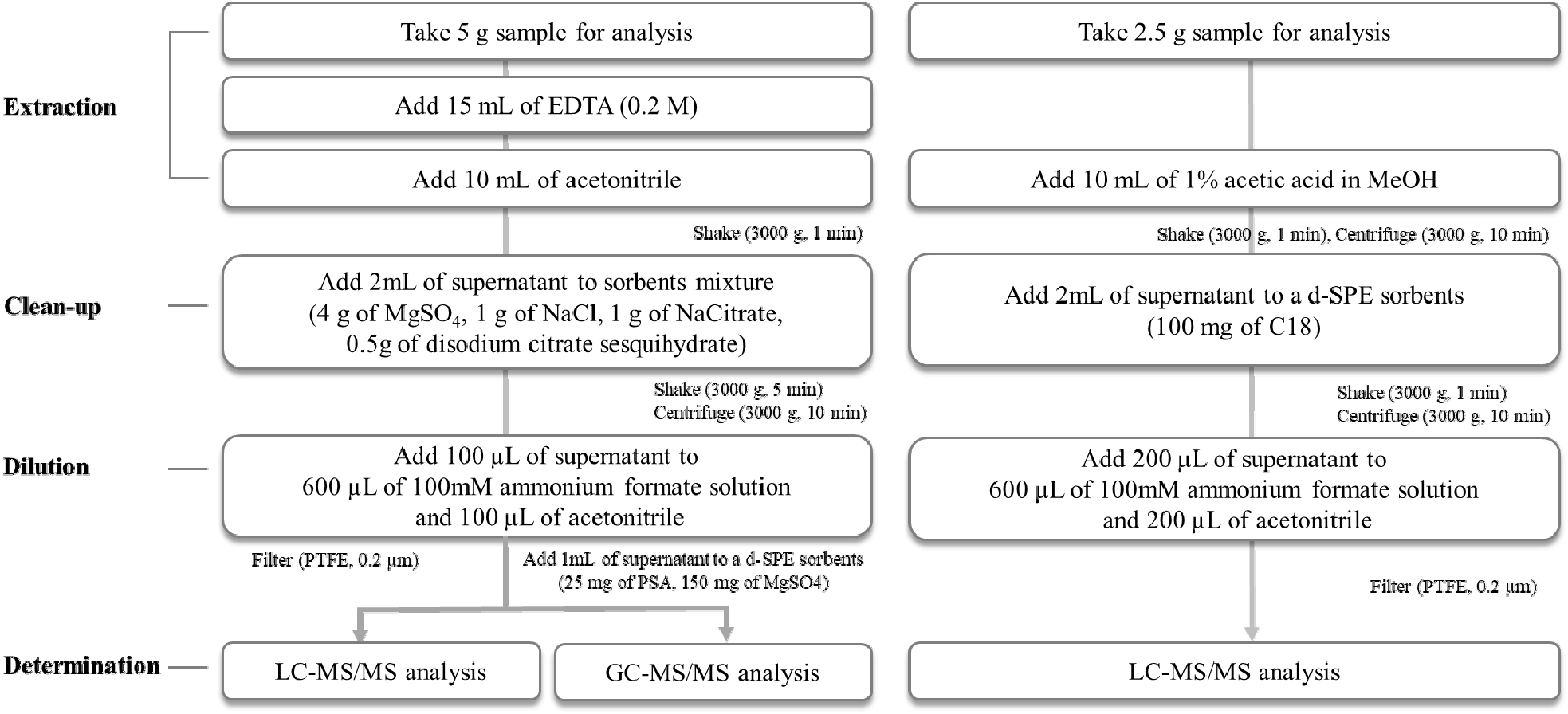
전처리방법은 본 실험실에서 사전에 개발한 방법을 활용하였다[6,8]. 전처리방법은 총 1법과 2법으로 나눠진다. 1법은 QuEChERS 기반으로 개발된 분석방법이며 비극성 물질에 적합한 전처리법이고, 2법은 극성 물질 추출에 적합한 QuPPe 기반으로 개발된 분석방법이다. 두 가지 분석법에 대한 세부사항은 참고논문을 참고하며 각 분석법에 대한 모식도는 Fig. 1과 같다.
개발된 분석 방법은 선택성, 선형성, LOQ(limit of quantitation), 정확도 및 정밀도에 대해 테스트되었다. 유효성검증은 식품의약품안전처의 식품 등의 시험법 작성 표준절차 지침[12]에 따라 수행하였다. 분석법의 선택성을 확인하기 위해 미처리 시료와 표준물질을 첨가한 시료를 분석한 결과, 분석물질과 동일한 머무름 시간에 방해 피크가 없는 것을 확인했다. 검량선의 선형성은 예상 결정 계수(r2)를 사용하여 평가되었다. 분석법에 대한 LOQ는 S/N 비율의 9배에 해당하는 농도를 선정하였다. 공시료에 농약, 동물용의약품, 진균독소의 3가지 농도를 스파이킹한 후 회수율을 측정하여 정확도를 확인하였고, 상대표준편차(relative standard deviation, RSD)를 계산하여 정밀도를 검증하였다[13].
2023년 4월부터 12월까지 국내 유통 사료 및 수입사료 546점을 유통매장 및 공장에서 확보하였다. 단미사료 239점 배합사료 307점 분석하였다. 단미사료의 구성은 다음과 같다. 곡류 21점, 박류 45점, 섬유질류 47점, 강피류 31점, 견과종실류 13점, 과실류 1점, 남은음식물사료 4점, 단백질류 17점, 부산물 5점, 유지류 2점, 두류 1점, 혼합성 단미사료 9점, 반려동물 단미사료 43점으로 이루어 졌다. 배합사료의 구성은 다음과 같다. 개사료 103점, 소사료는 84점, 고양이 45점, 돼지 35점, 닭 26점, 반려동물 배합사료 6점, 기초 배합사료 3점, 오리 2점, 말 1점, 양 1점, 염소 1점으로 이루어졌다. 모든 시료는 1 kg을 분쇄하여 4 mm 체를 통과시켰으며, 이를 분석전까지 −4°C에서 냉동 보관하였다.
결과 및 고찰
잔류농약 327성분, 곰팡이독소 7성분, 동물용의약품 121성분을 포함한 총 455개 성분의 유해 화합물의 정량화 및 확인을 위해 가장 풍부한 전이(transitions)를 기반으로 다중 반응 모니터링(MRM)에서 최적화된 분석을 수행했다. 전구체 이온은 식품의약품안전처에서 권장하는 잔류농약 및 동물의약품 분석법과 농림축산식품부에서 제시하는 사료용 표준분석법을 이용하여 확인하였다[13,14]. 전구체 이온과 생성물 이온의 존재비와 획득 매개변수는 개별 표준 용액을 직렬 질량 분석기에 주입하여 결정되었다. 최적의 LC-MS/MS MRM 조건을 위해 포지티브 모드와 네거티브 모드에서 각 대상 화합물의 이온화 강도를 비교하였고. GC-MS/MS MRM 조건은 대상 화합물 및 선택된 전구체 이온의 전체 스캔을 수행했다.
정량한계는SANTE 정량한계 계산방법 가이드라인에 따라 계산되었고[13], 455개의 표적 분석물질에 대한 LOQ 값은 0.5–50 mg/kg 범위였다. 그 중 잔류농약 327개 성분(71.87%)은 전처리 제 1법에서 0.5–25 mg/kg, 제 2법에서 2.5–20 mg/kg의 LOQ를 기록했고, 곰팡이 독소 7개 성분(1.54%)은 1–20 mg/kg을 기록했으며, 121개 성분의 동물용의약품(26.59%)은 전처리 제1법에서 1–25 mg/kg, 제 2법에서 2.5–50 mg/kg을 기록했다.
정확성과 정밀도는 MFDS 가이드 기준 (8)에 따라 회수율과 RSD를 측정하여 평가되었다. 회수율 시험은 옥수수사료원료, 양축용 배합사료, 애완동물용 배합사료를 포함한 3종의 매트릭스에 대해 각 목적물질의 LOQ, 2LOQ, 5LOQ 농도수준에서 3회 반복하였다. 각 목적물질(455개 성분)의 회수율 시험 결과, 전처리법 중 1법에서 잔류 농약(325개 성분)은 RSD가 14.9% 이하인 3종의 매트릭스에 대해 61.3%–119.7%의 회수율을 기록했다. 동물용의약품(92개 성분)은 60.8%–117.3% (RSD≤15.0%)의 회수율을 기록했으며, 곰팡이 독소(7개 성분)는 62.3%–110.0%(RSD≤14.1%)의 회수율을 보였다. 2법에서는 잔류 농약(2 성분)이 83.3%-101.7%(RSD≤9.8%)의 회수율을 나타냈고 동물용의약품(29개 성분)은61.3−119.3%(RSD≤14.3%)의 회수율을 기록했다. 다양한 매트릭스에 따른 회수율 비교 결과, 455개의 목적물질은 옥수수 사료 성분에 대해 61.3%–118.7%(RSD≤15.0%)의 회수율을 기록했고, 양축용 배합사료는 61.3%–119.7%(RSD≤14.90%)의 회수율을 나타냈으며, 애완동물용 배합사료는 60.8%–118.9%(RSD≤15.0%)의 회수율을 보였다. 실험실의 회수율과 RSD 값을 보고하는 전체 데이터세트는 Table 1에서 확인할 수 있다.
LOQ, limit of quantitation; RSD, relative standard deviation; NA, not applicable.
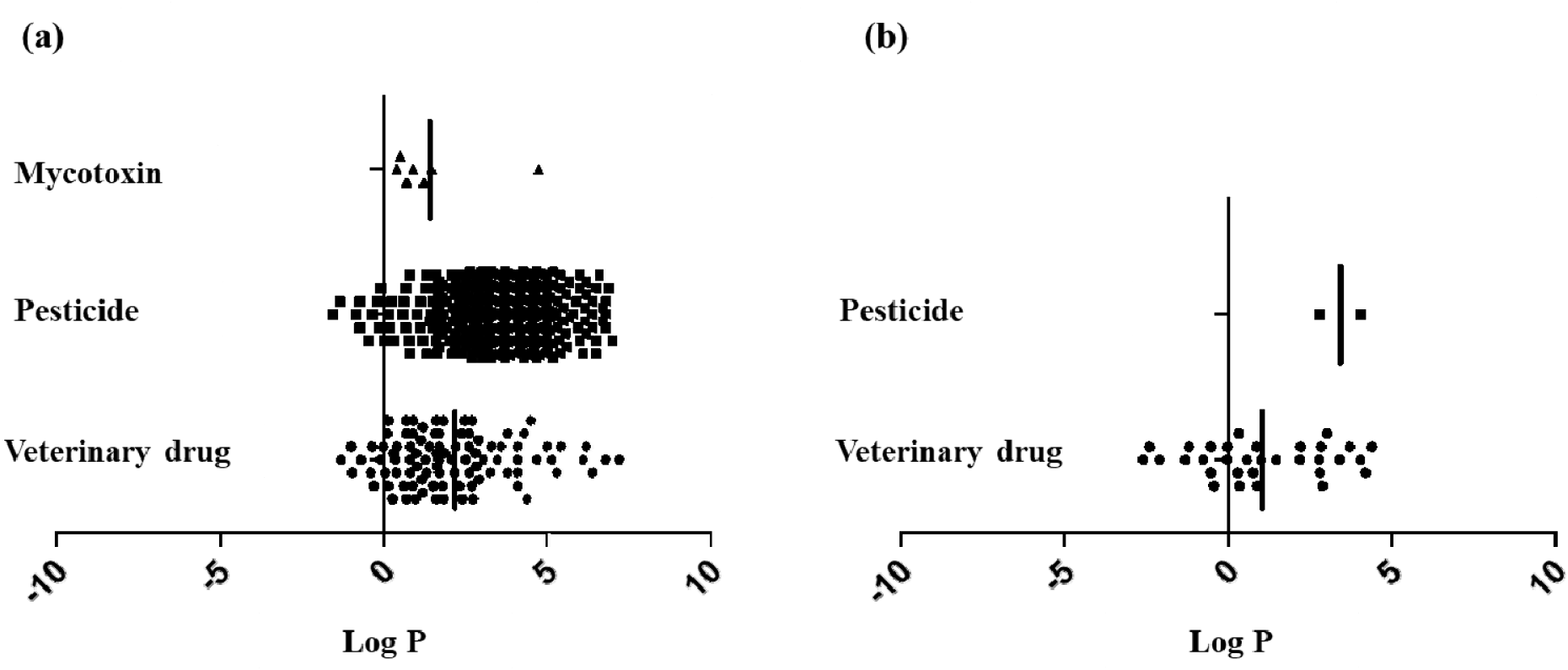
유효성 검증 결과에서 확인할 수 있었던 것처럼 통합적유해물질 분석법은 다양한 물질들에 대한 순차 분석이 가능하였다. 이는 추출용매의 극성을 달리한 두개의 분석법을 활용하여 주로 사용되는 유해물질들에 대한 동시분석의 효율을 극대화하였다. 다양한 물리화학적 특성을 갖는 물질들에 대한 분석이 가능함을 확인하였으며, 그 예로 대상 물질의 Log P 값을 살펴보면 매우 고르게 분포하고 있음을 알 수 있다(Fig. 2).
사료는 총 546점을 분석하였으며 단미사료 239점 배합사료 307점으로 구성되었다. 유해물질 계열별, 사료별 조사 결과 및 잔류 특성은 다음과 같다.
배합 및 단미·보조사료 546점 가운데 174점에서 피리미포스메틸 등 42성분이 344회 검출되었으며, 강피류, 섬유질류에서 검출된 아세타미프리드와 같이 미관리농약은 21점에서 16성분이 32회 검출, 강피류, 기타혼합제에서 검출된 아족시스트로빈 같이 해당 사료 품목에 기준이 설정되지 않은 농약은 13점에서 13성분이 32회 검출되었다. 허용기준이 설정되어 있는 성분들은 모두 허용기준 이내의 결과값을 갖고 있었다. 가장 높은 빈도로 검출된 성분은 ① 피리미포스메틸(살충제), ② 피페로닐부톡사이드(살충 효력증강제), ③ 프로피코나졸(살균제) 순이었으며, 국내 미등록 약제가 높은 비율로 검출되어 원료 등의 높은 수입 의존도에 기인한 것으로 판단된다.
피리미포스메틸(pirimiphos-methly)은 유기인계 농약(organophosphate, OP)으로 해충으로부터 식품을 보호하기 위해 주요 곡물 생산 국가에서 널리 사용되며, 일반적으로 저장된 곡물에 직접 사용되므로 농약 잔류물이 문제가 된다. 또한, 피리미포스메틸은 상업용 대서양 연어 사료에 존재하는 가장 널리 퍼진 살충제 중 하나로 알려졌다[15,16]. 고용량에서 피리미포스메틸 및 기타 유기인 살충제의 독성 메커니즘은 신경계의 아세틸콜린에스테라제(AChE) 효소 활성을 억제하여 신경 말단에 아세틸콜린이 과잉 생성되고 메스꺼움, 구토, 콜린성 효과, 쇠약, 마비, 발작과 같은 급성 증상이 나타난다[17]. 포유류 연구에 따르면 피리미포스와 그 대사물질은 산화 스트레스를 유발하고 간독성을 유발할 뿐만 아니라 유전독성을 일으키고 생식에 영향을 미칠 수 있는 것으로 나타났다[18,19]. 1992년 JMPR에서는 피리미포스-메틸의 일일 허용 섭취량(acceptable daily intake, ADI)을 체중 kg당 0.00–0.03 mg으로 설정했다[20]. 농산물 중 피리미포스-메틸의 최대 잔류 한계(maximum residue limit, MRL)는 밀 7 mg/kg, 옥수수 7 mg/kg 등으로 설정되어 있으며, codex의 기준에는 곡물 7 mg/kg, 밀기울 15 mg/kg 및 특정 동물성 제품 0.01 mg/kg 등으로 설정되어 있다. 쌀에 대해서는 유럽 연합 5 mg/kg, 미국 8 mg/kg 및 Codex 7 mg/kg로 설정되어 있다.
피페로닐 부톡사이드(Piperonyl butoxide)는 주로 살균제(예: 소독제, 해충 방제 제품) 및 의약품과 같은 제품에 사용된다. 이 물질은 산화물질과 반응할 수 있으므로 조심히 다루어야 한다. 동물에서 피부 및 호흡기 자극을 일으킬 수 있지만 심한 손상을 일으키지는 않는다. 인간에서 발암원으로의 증거는 없으며 IARC(International Agency for Research on Cancer) 발암성 등급에 의해 3군으로 분류된다[21]. 동물 발암성시험 결과에서는 대상 랫드 또는 마우스에 대해 발암성이 없음이 확인되었다. 검출된 사료의 경우 주 원료가 어류, 가금류, 옥수수 등이었다. 그리고 적용 대상이 개사료의 비중이 더 높았지만 고양이 사료와의 큰차이는 없었다. 농산물 중 피페로닐 부톡사이드에 대한 국내 기준은 곡류 20 mg/kg, 옥수수 30 mg/kg 등으로 설정되어 있으며, codex의 기준에는 육류 2 mg/kg, 가금류 고기 7 mg/kg, 옥수수 기름 80 mg/kg 등으로 설정되어 있다. 성분 자체의 독성은 크지 않은 것으로 조사되고 있지만, 가축과 다르게 반려동물의 경우 평균 기대수명이 점차 높아짐에 따라 지속적으로 노출될 가능성이 있다. 예로 영국 반려견의 품종군별 기대수명과 관련된 한 연구에서 반려견의 평균 기대수명을 11세로 보았다[22]. 이와 관련해서 반복투여 독성조사결과를 몇 가지 살펴보면, 먼저 포유류의 만성독성 연구에서는 5,000 ppm NOAEC으로 관찰된 모체 랫드와 자손의 체중감소는 2세대 랫드의 생식연구에서 1,000 ppm NOAEC으로 확인되었다[23]. 그리고 피페로닐 부톡시드(순도 90.78%)를 1년 동안 0, 100, 600 그리고 2,000 ppm(순도 보정) 농도로 4마리의 비글에게 사료를 통해 노출시킨 연구에서는 2,000 ppm 농도의 암수 모두에서 체중 감소, 혈청 콜레스테롤 감소 및 알칼리성 인산 가수분해 효소 활성의 증가, 간 중량 증가, 간세포 비후의 경증확산(위의 변화와 관련 있다고 추정됨)이 나타났다[24]. 이처럼 지속적으로 피페로닐 부톡시드에 노출될 경우 부작용이 있을 수 있으며, 반려동물에 맞는 정확한 연구가 수행되지 않은 만큼 해당성분에 대한 기준 검토가 필요할 것으로 보여진다.
프로피코나졸은(propiconazole)은 곰팡이의 침입으로부터 다양한 작물을 보호하는 데 사용되는 트리아졸 살균제이다. 프로피코나졸(propiconazole, PRO)은 다른 트리아졸 살균제와 마찬가지로 진균 에르고스테롤의 생합성을 방해하여 진균 세포벽의 형성에 영향을 미친다[25]. 다른 트리아졸계 살균제와 달리 프로피코나졸은 분해가 어렵고 광범위한 수생생물에서 상대적으로 높은 급성 독성을 나타낸다[26]. 프로피코나졸(PRO)는 쥐에서 신경독성 증가[27], 생식독성[28] 및 간독성 사고[29]와 관련이 있는 것으로 보고되었다. 설치류를 대상으로 한 장기간의 섭식 연구에서 프로피코나졸 노출이 간세포 선종 및 암종의 발생률 증가와 관련이 있는 것으로 보고되었다. 미국 EPA는 프로피코나졸을 인간 발암 물질로 식별했다[30]. 프로피코나졸의 독성은 2004년 JMPR에서는 일일 허용 섭취량(ADI)을 체중 kg당 0.00–0.07 mg으로 설정했다. Propiconazole에 대한 국내 잔류허용기준은 곡류(밀, 보리, 호밀)에 각각 2 mg/kg과 콩류에 5 mg/kg이 설정되어 있다. Codex에서는 우리나라와 비슷하게 곡류의 짚류(straw)에 대해 2 mg/kg 콩류에 대해 5 mg/kg으로 propiconazole의 잔류허용기준이 설정되어 있고, 미국의 경우 짚류에 대해 propiconazole이 10–40 mg/kg으로 기준이 설정되어 있다.
미국 식품의약품안전청에 보고된 2012년의 잔류농약 모니터링 결과[31]를 살펴보면, 미국에서 생산된 173점의 사료 샘플 중 34.1%가 잔류허용기준 이하로 검출되었고, 2.3%가 잔류허용기준을 초과하였다. 수입 사료 110점의 샘플 중 27.1%가 잔류허용기준 이하로 검출되었고, 1.9%가 잔류허용기준을 초과하였다. Ethoxyquin과 malathion이 가장 검출빈도가 높은 농약이었고, 우리나라의 모니터링에서 검출된 pirimiphos-methyl, piperonyl butoxide, propiconazole도 검출 농약에 포함된다. 2015년 국내 유통 사료에 대한 농약 잔류실태 조사 결과에 따르면[32], 사료 중 농약 잔류실태 조사를 위해 국내 유통 사료 126점을 수거하였고, 126점의 사료 중 106점(84.1%)이 불검출이었고, 20점(15.9%)에서 7성분이 농약잔류허용기준 이하로 검출되었다. 검출빈도가 높은 농약으로는 pirimiphos-methyl과 cyproconazole로 각각 사료 5점에서 검출되었다. 이 밖에도 propiconazole, azoxystrobin, tricyclazole 등이 검출되었다. Pirimiphos-methyl은 배합사료 5점에서 0.12–0.30 mg/kg 수준으로 검출되었고, propiconazole은 섬유질사료 3점에서 0.10–1.48 mg/kg 수준으로 검출되었다.
단미사료(197점)에서는 식물성(섬유질류 35점, 강피류 42점, 박류 8점, 견과종실류 2점, 곡류 2점, 식품가공부산물류 1점, 콩류 1점)에서 36점 91건 검출되었고, 기타·혼합성 사료에서 8점 21건 검출되었다. 강피류에서 검출빈도 수 높은 농약은 순서대로 cyhalothrin(4), acetamiprid(3), bifenthrin(3), chlorantraniliprole(3), chlorypyrifos(3), diuron(3), malathion(3), thidiazuron(3) 등이다. 섬유질류에서 검출 빈도 수 높은 농약은 순서대로 propiconazole(7), azoxystrobin(5), epoxiconazole(4) 순이다. 단미사료 분류에 따른 농약 검출률은 섬유질류(40%), 강피류(33%), 남은음식물(9%), 박류(6%) 순으로 높게 나타났다. 섬유질류, 강피류에서 높은 검출률을 보였으며, 배합사료 원료로 빈번하게 사용되어 해당 품목 또는 배합사료에 허용기준을 설정하거나 별도의 기준 적용방법을 제시가 필요할 것으로 판단된다.
배합사료(150점)에서는 축종별(소 47점 91건, 돼지 25점 50건, 닭 18점 29건, 말 1점 1건, 오리 2점 2건) 93점 173건 검출되었다. 소 사료에서 많이 검출된 농약은 propioconazole(20), pirimiphos-methly(16), 2,4-d(9) 순으로 검출되었다. 돼지 사료에서 많이 검출된 농약은 pirimiphos-methly(23), piperonyl butoxide(14), melathion(7) 순이다. 닭사료에서 많이 검출된 농약은 pirimiphos-methly(16), piperonyl butoxide(6), deltamethrin(3), malathion(3) 순이다. 배합사료에서 미관리농약이 검출된 건수는 4건이며, 플루오피람, 메트라페논, 디페닐라민이 검출되었다.
반려동물 사료에서는 36점의 사료에서 57건의 농약이 검출되었다. 개 사료에서 많이 검출된 농약은 chlorpropham(12), pirimiphos-methly(8), piperonyl butoxide(7) 순이다. 고양이 사료에서 많이 검출된 농약은 chlorpropham(6), piperonyl butoxide(3) 순이다. 미관리농약이 검출된 건수는 2건이고, 그 성분명은 페노타프롭에틸, 피리달리이다. 반려동물용 배합사료에서만 검출된 클로로프로팜은 주로 식물 성장 조절제, 제약, 제초제, 살충제 사용된다. 경구, 복강 투여로 다양한 동물에서 광범위한 급성 독성이 나타나며 반수치사량(LD50)은 랫드 복강 투여 시 700 mg/kg, 마우스 복강 투여 시 2,600 mg/kg, 토끼 경구 투여 시 5,000 mg/kg, 닭 경구 투여 시 >5,000 mg/kg로 나타났다. 또한, 임신한 랫드에 노출시 모체 독성이 관찰되었다. IARC 발암물질 분류에서 인체에 발암 분류 불가물질로 제시되어 있다(Group 3). 단회투여 독성관련연구결과, 클로로프로팜을 실험실 동물에게 독성 효과를 나타내는 농도로 단일 횟수의 경구 투여 후, 무력감, 운동 실조, 비 출혈, 안구 외근, 출혈성 출혈을 포함하는 초기 증상 관찰되었다. 이들은 호흡 곤란, 부복, 무뇨증, 당뇨, 단백뇨, 고열 및 사망으로 진행되었다. 부검 결과 때때로 뇌, 폐 및 기타 기관의 혼잡과 함께 위장염이 나타났다. 스트레스 반응은 부신, 흉선, 비장에서 뚜렷하지만, 신장과 간에서 퇴행성 변화가 나타났다[33]. 반복투여 독성관련연구결과, 클로르프로팜을 알비노 랫드에 식사량의 2% 수준으로 경구투여로 90일 동안 먹인 결과, 사망이나 미세 병리학적 이상은 발생하지 않았다[34]. 동물발암성 시험관련해서 클로로프로팜은 마우스, 랫드와 햄스터에게 경구로 투여하거나 마우스에 피하로 투여했을 때 발암 효과를 나타내지 않았다. 마우스와 햄스터를 대상으로 한 연구에 사용된 용량은 반드시 최대 허용 용량과 일치하지 않았다. 마우스에 경구 투여한 한 실험에서 클로로프로팜은 피부 발암의 개시 제로 작용했다. 이는 후속 실험에서 확인되지 않았다[35]. 클로로프로팜에 대한 국내 기준은 없지만 codex의 기준에는 소고기 0.1 mg/kg, 감자 30 mg/kg 등으로 설정되어 있다(Table 2).
MRL, maximum residue limit; NA, not applicable.
546건 가운데 동물용의약품은 검출된 건수가 없었다. 하지만 LOQ 이하의 값이 검출된 경우는 Clopidol이 9건 검출되었고(0.0098–0.0207, 소사료 1건, 개 4건, 고양이 3건, 개고양이 1건) Virginiamycin이 5건(0.0245–0.0372, 주정박 5건) 검출되었다.
현재 사료 등의 기준 및 규격에는 사료 내 사용 가능한 동물용의약품의 종류 및 사용기준이 설정되어 있으며, 이 중 설정된 항목 9종 중 8종이 항콕시듐제(나라신, 디클라주릴, 라살로시드나트륨, 마두라마이신암모늄, 모넨신나트륨, 살리노마이신, 샘두라마이신, 크로피돌)이다. 항콕시듐제는 가금류에 지속적으로 사용되고 있으며, 첨가제로서 사용되므로 잔류가능성이 매우 높다고 할 수 있다. 실제로 잔류특성에 관한 연구에서, 니카르바진 및 디클라주릴과 같은 콕시듐제 물질은 사료를 제분한 후 사료 분쇄기 생산 라인을 오염시킬 수 있으며, 다른 사료를 오염시킬 수 있다고 밝혔다[36]. 여러 연구에 따르면 실제로 기존의 다품종 공장에서 프리믹스 및 복합 사료를 완전히 오염 없이 생산하는 것은 불가능하다고 보고된다[37]. 때문에 가축과는 달리 반려동물의 경우 이러한 항콕시듐 화합물에 지속적으로 노출될 수 있어 새로운 기준이 필요하며, 현재 국내 기준이 설정되어 있는 다른 항콕시듐 화합물과 마찬가지로 나이카바진이나 디클라주릴과 같이 같은 계열의 화합물이지만 국내 사료 첨가제로 사용불가능한 성분들에 대한 기준 검토가 필요할 것으로 판단된다.
클로피돌은 항콕시듐제로 Eimeria tenella, E. necatrix, E. acervulina, E. maxima, E. mivati 및 E. brunetti에 의한 콕시듐증을 예방하고 육계에서 클로르테트라사이클린에 민감한 Mycoplasma synoviae에 의한 감염성 활막염을 제어한다. Reid & Brewer는 클로피돌이 가금류의 질병률과 사망률을 억제할 뿐만 아니라, 체중 증가와 사료 전환 효능도 증가시킨다는 사실을 발견했다[38]. 클로피돌은 또한 다른 기생충에 대해서도 효과적인 것으로 나타났다. 쥐, 병아리, 원숭이, 인간에서 수많은 말라리아 종에 대한 활성을 보고했고[39], 어린 양의 수많은 자연 감염과 칠면조의 Leucocytozoon smithi에 대해서도 효과가 있는 것으로 나타났다[40]. 클로피돌은 기생충 발생을 최소화하며 가금류의 면역력을 향상을 위해 광범위하게 활용된다. 미국에서 클로피돌은 반추 동물 및 돼지 치료를 위해 등록된 항콕시듐제이며 주로 항균제 및 성장 촉진제와 결합된 사료 첨가제로 조합되어 사용된다[41]. 권장 복용량 수준은 사료의 0.0125% 또는 사료의 약 0.25 1b/톤이다. 미국은 2017년에 의학적으로 중요한 항생제의 사용을 수의사의 감독이 필요한 수의사료지침(veterinary feed directive, VFD)으로 제한했다[42]. 클로피돌(clopidol)은 포자동물(sporozoites)과 영양동물(trophozoites)에서 미토콘드리아 에너지 생산을 억제함으로써 에이메리아 종(Eimeria spp.)의 초기 발달에 대해 광범위한 콕시듐스타트 활성을 가진 피리디놀(pyridinol)이다[43]. 콕시듐스타트는 기생충 대사에 영향을 미쳐 기생충 생화학적 경로를 억제한다. 이는 심각한 감염에 효과적이지만 장기적으로는 내성을 증가시킬 수 있고, 닭고기 제품의 약물 잔류물은 소비자의 건강에 악영향을 미친다[44,45]. 클로피돌 노출로 인한 인간과 동물에게 미치는 영향 및 독성 매커니즘에 대한 정확한 증거는 부족하다. 클로피돌은 동물에서 경구 섭취 후 빠르게 흡수되어 배설되는데 토끼의 경우, 클로피돌 16 mg/kg bw를 1회 또는 여러 번 경구 투여한 후, 90% 이상이 투여 후 24시간 이내에 소변으로 배설되었다[46]. 쥐에게 10 mg/kg 또는 50 mg/kg을 경구 투여한 경우 투여된 방사능의 각각 약 65% 및 80%가 소변으로 배설되었고 나머지는 대변으로 배설되었다[47]. 쥐, 토끼, 기니피그의 LD50 값은 8,000 mg/kg bw 이상이었다. 2년 동안 각각 15 mg/kg 또는 5 mg/kg bw를 매일 먹인 쥐와 개에서는 아무런 효과도 관찰되지 않았고[48], 2년 동안 개에게 200 mg/kg/day까지의 용량은 독성 효과가 없는 것으로 나타났다[49]. 양에게 500 mg/kg 식품에서 잘 견디며, 900 및 1,800 mg/kg 식품 용량에서는 독성 효과가 관찰되지 않았다. 기형 발생성 연구에서는 클로피돌은 쥐와 토끼의 생식력, 임신, 생존력, 수유 또는 기형 발생성에 대한 부작용을 유발하지 않았다고 밝혔다. 그러나 다른 쥐 연구에서는 기관 형성 과정에서 100 또는 200 mg/kg bw의 용량을 투여하면 태아 체중과 크기가 감소하여 클로피돌이 쥐의 자손 발달에 영향을 미칠 수 있다고 보고했다. 또한 생체 내 유전독성 연구의 결과에서 클로피돌이 돌연변이 유발 활동을 할 수 있다고 결론을 내렸지만, 클로피돌의 돌연변이 유발성/유전독성 및 생식독성은 데이터가 불완전하므로 잠재적인 위험의 특성을 특성화하기 위해 연구의 추가 작업이 수행되어야 한다[50]. Capleton et al.은 독성학적 특성을 일일 섭취 허용량(ADI), 독성 종점 발암성, 변이원성, 생식 독성, 신경 독성, 면역 독성, 내분비 독성, 미생물학적 영향, 일반 독성, 생물학적 반감기, 대사 활성을 포함한 여러 매개변수에 대한 독성 증거를 기반으로 83개의 동물용의약품에 대한 ’Total Toxicity Profile Score’(TTPS)를 얻은 후 tertiles를 계산하여 각 화합물을 ’높음’, ’중간’ 또는 ’낮음’으로 전체 독성 프로파일을 분류했다[51]. 단일 동물용의약품이 달성할 수 있는 최대 TTPS 점수는 57점이었다. 이러한 정보는 주로 유럽 의약청(http://www.emea.eu.int), 화학 안전에 관한 국제 프로그램(http://www.inchem.org/) 및 TOXNET(http://www-toxnet-nlm-nih-gov.libproxy.knu.ac.kr), 식품의약국 수의학 센터(http://www.fda.gov/cvm/default.html)를 참고했다. 그 결과 클로피돌은 상대적 독성 프로필 분류 ’낮음’(<19)의 범주로 분류되었다. 또한 영국 내 동물용 의약품의 사용량에 대한 데이터에 따르면 클로피돌은(Boxall et al.의 분류에 따라[52]), ’높음’ 사용량(연간 ≥ 10톤)으로 분류되었다. 자세한 독성학적 특성이나 사용량의 데이터는 추가로 조사되어야 하지만, 많은 양으로 판매되는 동물용 의약품은 소량으로 사용되는 의약품보다 간접적 노출 가능성이 더 높으므로 지속적으로 모니터링 할 필요성이 있다. 또한, 1990년에 여러 국가에서 육류, 계란 및 기타 조직에 콕시듐스타트 잔류물이 있음을 고시했다. 식품의 콕시듐스타트 잔류물은 현재 더 면밀히 연구되고 모니터링되어야 한다.
버지니아마이신은 닭, 돼지, 송아지의 성장 촉진, 사료효율 개선 및 질병 예방 및 치료에 쓰이고 있어 의도적인 혼입 가능성이 있다. 또한 반려동물용 배합사료에 검출된 베르베린은 황백나무 지표성분이자, 가축의 지사제, 항균제 등으로 사용되어 원료에 의한 혼입이라고 보여지나 의도적 혼입 가능성에 대해서도 지속적으로 모니터링 할 필요성이 있다.
동물용의약품의 국내 동물용의약품 관리는 사료에 혼합 가능한 9종을 제외하고는 불검출 기준을 적용하고 있으나, 9성분 이외의 물질들이 지속적으로 미량 검출됨에 따라 지속적인 모니터링이 필요하며, 사료 검정 및 모니터링 성분의 범위에 대한 기준 설정이 필요하다.
곰팡이독소 11성분에 대한 잔류량 조사 결과, 관리대상인 아플라톡신, 오크라톡신은 불검출이었다. 데옥시니발레놀은 89건 검출이 되었으며, 단미사료에서 33건, 배합사료에서 54건 검출되었다. 단미사료의 경우 강피류 15건, 박류 15건, 곡류 2건, 부산물 1건, 섬유질류 1건, 혼합제 1건 순으로 검출이 되었고, 배합사료는 소사료에서 39건 돼지사료에서 7건, 닭사료에서 3건, 개사료에서 2건, 말, 양, 염소에서 각 1건씩 검출되었다.
곰팡이독소는 가축에 만성 또는 급성 독성을 일으키는 다양한 곰팡이 종의 2차 대사산물이다. 진균 독소인 Deoxynivalenol, Zearalenone, Fumonisin은 주로 Fusarium 곰팡이에 의해 생산된다[47]. Fusarium 균류는 온대 지역에서 가장 흔한 독소 생성 균류이며 옥수수, 밀, 보리, 귀리 등 전 세계적으로 다양한 곡물에서 발견된다[53–55]. Rodrigues & Naehrer[56]는 전 세계 단미 사료 및 복합 사료에 곰팡이 독소가 존재한다는 3년간의 조사를 보고했다. 아플라톡신(AFs), ZEN(zearalenone), DON(deoxynivalenol), FUM 및 ochratoxin A(OTA)는 미주, 유럽 및 아시아에서 콩 박, 밀, 옥수수, 단미사료 샘플 및 말린DDGS(distiller’s dried grains with soluble)을 포함한 모든 분석 샘플의 33%, 45%, 59%, 64% 및 28%에서 검출되었다. FUM, DON, ZEN 순으로 높은 발생률을 보였다. 또한, 곡물 샘플(하나 이상의 진균독 함유)에서 진균독소의 동시 발생이 자주 보고되었다[57–59]. ZEN과 DON은 모두 Fusarium graminearum 또는 F. culmorum에 의해 생산되기 때문에 ZEN과 DON의 동시 발생은 각각 비육용 사료의 48%, 옥수수의 39%, 밀 샘플의 28%에서 검출되었다(ZEN과 DON은 밀 샘플에서 가장 자주 관찰된 마이코톡신 조합이기도 함). 이는 다중 마이코톡신 오염의 시너지 효과를 고려하는 것이 중요하다는 것이 강조된다.
데옥시니발레놀(DON)은 F. graminearum 및 F. culmorum이 일반적으로 생산하는 B형 트리코테센으로 돼지의 구토 효과와 사람의 위장 장애 때문에 구토독소로도 알려져 있다. DON은 또한 170°C–350°C 범위의 온도를 견디는 매우 내열성이 높으며 곰팡이 독소 오염의 일반적인 식이 오염 물질이다[60–63]. DON의 급성 독성 영향에는 구토, 설사 및 식욕 부진이 포함되고 DON에 만성적으로 노출되면 식욕 부진, 성장 지연, 면역 독성 및 생식 독성을 유발한다[64–66]. DON 및 관련 대사체를 섭취한 후 발생할 수 있는 잠재적인 건강 위험을 피하기 위해 이러한 독소의 일일 섭취 한계량(tolerable daily intake, TDI)에 관한 법률이 발표되었다. FAO/WHO(Food and Agriculture Organization of the United Nations/World Health Organization)의 식품 첨가물 전문가 공동 위원회(JECFA)는 최대 TDI를 DON, 3-ADON 및 15-ADON의 합에 대해 1 μg/kg b.w. day−1로 설정하였다. 또한, DON의 1일 허용섭취량(ADI)은 성인: 3, 어린이: 1.5(μg/kg body weight)이다. 미국 식품의약국(Food and Drug Administration, FDA)은 식품의 DON에 대한 최고 허용 한도를 1 mg/kg로 규정했고 미국 내 밀 및 밀 제품의 허용 한계는 4 mg/kg을 초과해서는 안 된다고 규정했다. 대조적으로, 유럽 연합의 곡물 가루 및 옥수수의 DON 함량은 <0.75 mg/kg이어야 하며 이 제한은 비교적 엄격하다. DON은 주로 밀, 보리, 귀리, 호밀, 옥수수, 감자 등 녹말이 많은 주식을 오염시키며, 그 중 밀, 옥수수, 귀리가 가장 오염되어 있다[55,67]. 식품 및 동물 사료에서 DON의 발생은 축산업과 식품 및 사료의 공급망 및 국제 무역에 중요한 문제이다[68,69]. 아시아, 아프리카, 아메리카, 유럽 및 중동은 모두 DON 오염의 영향을 받는다[70]. 최근 요약된 보고서에 따르면 단미사료 및 복합사료의 DON 농도 범위 값은 북미, 중남미, 유럽, 아시아, 오세아니아, 아프리카에서 각각 1,947 μg/kg, 51–237 μg/kg, 88–968 μg/kg, 61–691 μg/kg, 94 μg/kg, 745 μg/kg이었다[71]. 중국에서는 총 56개의 밀 샘플에서 DON 오염 수준을 분석했다[72]. 그 중 시리얼 샘플의 89.3%가 259–4,975 μg/kg 범위의 DON으로 오염되어 있었다. 튀니지에서 실시한 한 연구에서 밀 샘플(65개)은 12.8 ± 5%에서 30.5 ± 13.3% μg/g 범위의 DON으로 오염되었다[73]. Pietsch et al.은 중부 유럽에서 수집 된 상업용 어류 사료 샘플 (11)의 81.8%가 DON으로 오염되었다고 보고했고 평균 오염 값은 289 μg/kg이다[74]. 한국에서는 배합사료와 사료원료의 각각 91.3%와 53.3%에서 DON이 검출되었다[75].
연구에서 제랄레논은 총 39건 검출이 되었으며, 단미사료에서 16건, 배합사료에서 23건이 검출되었다. 단미사료의 경우 강피류 9건, 박류 5건, 곡류와 섬유질류에서 각 1건 순으로 검출이 되었고, 배합사료는 소 사료에서 15건, 개사료, 닭, 돼지 사료에서 각 2건, 고양이, 양 사료에서 각 1건 검출이 되었다[76].
제랄레논(ZEN)는 각종 Fusarium 균류, 주로 F. graminearum에 의해 생성되는 비스테로이드 유형의 에스트로겐 마이코톡신이다[72]. ZEN은 화학 구조가 자연적으로 발생하는 에스트로겐과 유사하기 때문에 에스트로겐 활성을 가지고 있다. 에스트로겐 수용체(estrogen receptor, ER)에 결합하여 인간과 동물에게 내분비 교란 효과를 발휘할 수 있다[77,78]. ZEN의 급성 독성은 상대적으로 낮아 국제암연구소(IARC)에 의해 ZEN을 3군(인체 발암 물질로 분류할 수 없음) 발암물질로 분류되었다[79]. 이전 문헌에 따르면 ZEN의 만성 섭취는 생식 독성, 간 독성, 면역 독성, 유전 독성 및 발암성을 포함한 여러 만성 독성 효과를 유발할 수 있다[80]. 또한, ZEN에 장기간 노출되면 인간의 유방암 발병 위험이 증가된다고 밝혀졌다. 암컷 동물의 경우 ZEN에 노출되면 발정 동기화, 불규칙한 주기, 불임, 심지어 낙태로 이어질 수 있다. 수컷 동물에서 제랄레논 노출은 정자 생산과 품질을 감소시킬 수 있다[81]. 돼지는 가축 중에서 ZEN에 가장 취약한 동물로 보고되었다. ZEN은 쥐와 돼지의 생식 장애를 일으키고, 가축과 가금류의 불임을 유발하며, 생식 기관의 형태학적 변화를 일으킬 수 있다. 또한 염색체 이상과 DNA 가닥 파손을 유발하고 염증성 사이토카인 수치를 조절할 수 있다[82]. 유엔 식량농업기구(FAO/WHO) 산하 식품첨가물 공동전문가위원회는 2000년 ZEN의 일일 허용 섭취량(TDI)을 체중 kg당 0.5 μg으로 규정했고[83], EFSA(European Food Safety Authority)는 2011년에 TDI를 체중 kg당 0.25 μg으로 수정했다[84]. 유럽 연합(EU)과 한국에서 동물 사료에 함유된 ZEN 함량의 지침 값은 옥수수 및 옥수수 부산물의 경우 3 mg/kg, 가금류 사료의 경우 0.1 mg/kg이다[85]. ZEN과 그 대사 산물은 옥수수, 밀, 보리, 귀리 및 기타 작물뿐만 아니라 생선, 닭고기 및 기타 동물성 식품에서도 검출된다. 최근 발표된 논문은 10년 동안 100개국에서 채취한 74,000개 이상의 샘플에서 얻은 곰팡이독소 농도를 요약했다[58]. 조사 결과에 따르면 ZEN은 전체 동물 사료의 3대 곰팡이 독소 중 하나이며, 전체 샘플의 45%에서 발생하고 양성 샘플 중 평균 농도가 55 μg/kg이다. ZEN 오염은 옥수수(44%), 옥수수-DDGS(75%), 대두박(61%), 밀(33%) 및 보리(20%)에서 발생했다. 또한, 옥수수, 밀, 귀리 및 기타 곡물 유래 식품의 30개 샘플에 대한 연구에서는 ZEN 발생률이 80%로 나타났다[57]. 세계보건기구(WHO)는 전 세계 작물에서 ZEN 발병률을 연구한 결과 작물의 약 30%–40%가 ZEN에 오염되어 있다고 보고했다[59]. ZEN 오염률은 곡물 및 곡물 기반 식품 샘플에서 2위를 차지했으며, 보리의 약 46%와 밀 제품의 24%가 ZEN로 오염된 것으로 제안되었다[80]. EFSA 패널의 설문 조사에 따르면 옥수수에서 ZEA 발생 빈도는 33%에 달했으며 평균 수준은 15 μg/kg에 도달했다[84]. 옥수수 배아 오일에서 ZEA 발생은 86%의 더 높은 비율을 차지했으며 평균 함량은 72 μg/kg으로 높았다[86]. Lee et al.은 지난 10년 동안의 전 세계 발생 데이터를 수집하여 생곡물의 ZEA 발생률과 최대 수준이 각각 46%와 3,049 μg/kg임을 제시했다[87]. 식품 및 동물 사료에서 ZEN의 발생은 전세계적인 문제이다. 최근 요약된 보고서에 따르면 북미, 중남미, 유럽, 아시아, 오세아니아 및 아프리카에서 사료 재료 및 사료에서 ZEN의 범위 값은 각각 217 μg/kg, 0–111 μg/kg, 3–37 μg/kg, 32–219 μg/kg, 50 μg/kg 및 25 μg/kg이었다[70]. 터키에서는 가축 사료가 테스트된 샘플의 45.2%에서 ZEN으로 오염되었으며[88], 사료 성분은 전체 샘플의 31.58%에서 ZEN으로 오염되었다[89]. 슬로바키아에서는 2004년에 테스트된 가금류 사료 샘플의 88%가 ZEN에 오염되었다[90]. 아시아와 오세아니아에서 Binder et al.은 사료 성분의 평균 ZEN 오염 수준이 0.077 mg/kg이라고 보고했다[91]. 한국에서는 0.009에서 0.405 mg/kg 사이의 농도로 테스트된 사료의 98%에서 ZEN이 검출되었다[75].
연구에서 푸모니신은 총 125건 검출이 되었으며, 단미사료는 39건 배합사료에서는 86건 검출이 되었다. 단미사료의 경우 박류에서 16건, 강피류에서 15건, 곡류에서 3건, 섬유질류, 혼합제에서 각 2건, 부산물에서 1건 검출이 되었고, 배합사료는 소사료에서 45건, 돼지사료에서 16건, 닭사료에서 11건, 개사료에서 8건, 오리사료에서 2건, 고양이와 양, 염소, 기타 배합사료에서 1건씩 검출이 되었다.
푸모니신은 F. verticillioides, F. proliferatum 및 기타 푸사리움 종에 의해 생성되는 진균 독소로, 주로 옥수수나 옥수수 부산물에서 발견된다. 10가지 이상의 푸모니신이 분리되고 특성화되었다. B형 푸모니신(FB1, FB2, FB3 및 FB4)은 사료에서 가장 흔한 천연 푸모니신인 것으로 추정된다(검출된 모든 푸모니신의 95% 이상). 오염된 옥수수에서 가장 널리 퍼진 곰팡이 독소는 FB1으로 가장 독성이 강한 것으로 여겨진다[92,93]. 이러한 독소는 스핑고지질 생합성을 방해하여 막 생합성에 심각한 문제를 일으킬 수 있다[94]. 푸모니신의은 급성 독성이 크지 않지만, 농도가 높아지면 신경 독성, 신장 독성, 간 독성, 면역 독성을 유발할 수 있으며 다양한 동물 종 및 인간의 소화 시스템에 독성 효과를 유도 할 수 있다[95]. 동물에서 푸모니신는 말의 백질뇌연화증[96], 돼지의 폐부종 증후군[97], 쥐의 간독성 및 신독성[98,99], 기타 종의 세포에서 세포사멸을 일으키며[100], 인간의 식도암을 유발한다[101]. 국제암연구소(IARC)에 따르면, F. verticillioides에서 유래한 FB1은 인간에 대한 푸모니신의 발암성에 대한 증거가 부족하지만 실험 동물에 대한 충분한 증거로 인해 2B군, 즉 인간에게 발암 가능성이 있는 것으로 평가된다[102]. 유엔식량농업기구(FAO)와 세계보건기구(WHO)는 푸모니신의 일시적인 최대 일일 허용 섭취량을 2 μg/kg bw/day로 설정했다. 유럽연합 집행위원회(European Commission, EC)와 한국에서는 사료 내 푸사리움 독소의 최대 수준 값이 설정되었고 푸모니신(FB1 + FB2)의 경우 사료에 대한 지침 값을 옥수수 및 옥수수 부산물 60 mg/kg, 가금류 사료 20 mg/kg으로 설정했다. 미국 식품의약국(FDA)은 2001년에 인간 식품 및 동물 사료의 푸모니신에 대한 지침 수준을 설정했고[103], 푸모니신이 5 ppm 미만으로 함유된 옥수수 및 옥수수 부산물은 모든 동물 사료에 사용하기에 안전한 것으로 간주한다. 푸모니신은 유럽(51%)과 아시아(85%)에서 발생하는 전 세계적으로 매우 민감한 문제이다[104]. Marquardt와 Madhyastha는 전 세계 사료 및 사료의 다양한 독소 수준을 조사했다. 50% 이상의 양성 샘플로 가장 높은 발생률은 북미, 남아시아 및 동남아시아, 남미, 남유럽 및 아프리카에서 발견되었다. 또한, 사료 및 식품에서 다른 관련 독소와 함께 푸모니신의 발생은 아르헨티나[105], 브라질[106], 중국[107], 이탈리아[108], 포르투갈[109], 스페인[110], 탄자니아[111] 및 태국[112]과 같은 다양한 국가에서 보고된다. Serrano et al.[113]은 태국의 옥수수 샘플 18개에서 푸모니신과 아플라톡신의 발생을 보고하고 옥수수 모래 샘플에서 FB1 및 FB2를 발견하고 F. moniliforme 및 F. proliferatum을 분리했다. 미국에서 수행된 연구에 따르면 FB1과 모닐리포르민은 옥수수 샘플의 34%와 옥수수 기반 식품의 53%에서 각각 존재한다고 보고되었다[114]. 2007년에서 2010년 사이 브라질에서 옥수수 기반 식품에서 푸모니신을 검출하기 위한 연구가 수행되었으며, FB1과 FB2가 각각 82%와 51%에서 발견되었다고 보고했다[115]. 한국의 가금류 육계 및 사료 비육 송아지에서 FB1 및 FB2에 의한 오염이 관찰되었다[116]. Abdallah et al.은 대추야자에서 FB2와 ochratoxin A와 B의 동시 발생을 발견했다[117]. 브라질에서는 F. verticillioides에 의한 푸모니신의 생성이 증상이 있는 곡물과 무증상 곡물 모두에서 발견되는 것으로 보고되었다[118]. 쿠웨이트의 한 연구는 테스트한 모든 가금류 사료 샘플(53개 샘플)이 220–6,000 μg/kg 범위의 푸모니신으로 오염되었으며 평균 오염 수준은 2,733 μg/kg이라고 보고했다[119]. 유사한 결과가 Greco et al.에 의해 보고되었다[120].
연구에서 T-2 는 단미에서 2건, 배합사료에서 1건 검출이 되었는데 단미사료는 곡류와 박류에서 1건씩, 배합사료는 돼지사료에서 1건 검출이 되었다.
HT-2 는 총 6건 검출이 되었는데 단미사료에서 5건, 배합사료에서 1건 검출되었다. 단미사료는 곡류에서 2건, 강피류, 박류, 섬유질류에서는 각 1건 검출이 되었고 배합사료는 돼지사료에서 1건 검출되었다(Table 3).
MRL, maximum residue limit; NA, not applicable.
결 론
QuEChERS와 QuPPe를 응용하여 개발한 2가지 분석법을 활용하여 다양한 계열의 잔류오염물질 459성분에 대한 분석법을 정립하였다. 이를 활용하여 1년 동안 사료 총 546점을 분석하였다. 국내 유통사료에서 검출된 잔류농약은 모두 허용기준 이내로 확인되었다. 동물용의약품의 경우 모두 정량한계 미만으로 확인되었다. 곰팡이독소의 경우 국내 관리대상인 아플라톡신과 오크라톡신은 모두 불검출이었다. 하지만 일부 기준이 설정되어 있지 않은 성분이나 국내 사용 등록 물질이 아닌 성분들이 검출되었다. 이는 원료 등의 높은 수입 의존도에서 기인한 것으로 판단되었다. 또한 해당 성분들에 대해서는 독성자료, 국내외 발생 보고자료, 허용 기준, 검출농도 등을 검토하였다. 이처럼 관리대상 이외의 잔류오염물질들이 확인되고 있어 수입원료에서 발생할 수 있는 잠재적인 위험성이 있는 물질들에 대한 지속적인 모니터링이 필요할 것으로 보인다. 또한 국내 기준이 설정되지 않은 성분들에 대한 연구와 노출 경로에 대한 지속적인 모니터링과 관리가 필수적임을 강조할 수 있다. 관리 기준이 설정되지 않은 성분들에 대해서는 추후에 더 많은 모니터링 자료를 확보하여 국내에서 추가적인 안전 기준 설정 및 관리 강화에 중요한 역할을 할 것이다.
